2024年ESMO大会上,由上海交通大学附属胸科医院韩宝惠教授牵头开展的特瑞普利单抗联用自体细胞因子诱导的杀伤细胞(CIK)疗法联合或不联合化疗一线治疗晚期非小细胞肺癌(NSCLC)的II期研究以壁报的形式公布了研究成果(摘要编号:#1322P),吸引众多国际学者关注和讨论。研究表明,特瑞普利单抗联合CIK和化疗一线治疗NSCLC可显著延长患者生存期且安全性良好,未发现新的安全信号。
特瑞普利单抗联合CIK和化疗(A组)对比特瑞普利单抗联合CIK(B组)治疗,两组中位无进展生存期(PFS)分别为20.0 vs. 6.0个月,HR=0.335(95%CI: 0.155-0.725),P=0.0038。
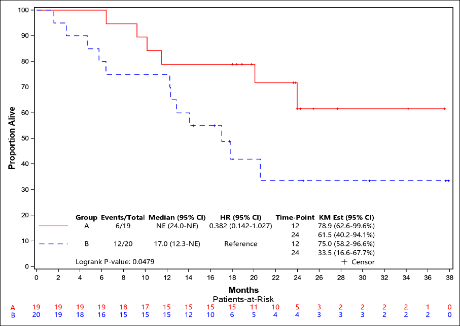
生存随访显示,A组和B组的中位OS分别为尚未达到 vs. 17.0个月,HR=0.382(95% CI: 0.142-1.027), P=0.0479。
 研究壁报照
研究壁报照
该研究是一项前瞻性、随机、II期临床研究(ChiCTR2000035573),计划纳入既往未接受任何系统治疗的PD-L1阳性(≥1%)、无EGFR/ALK突变的IIIB-IV期NSCLC患者,以1:1的比例随机分配接受特瑞普利单抗(240mg,d1,Q3W)+CIK(Q6W)+化疗(非鳞癌:培美曲塞+卡铂;鳞癌:吉西他滨+卡铂)(A组)或特瑞普利单抗(240mg,d1,Q3W)+CIK(Q6W)(B组)治疗,直至疾病进展或出现不可耐受的毒性。主要终点为安全性和PFS,次要终点包括客观缓解率(ORR)、疾病控制率(DCR)、缓解持续时间(DoR)和总生存期(OS)。
研究共随机40例患者,中位年龄64岁,60%的患者PD-L1表达≥50%。A组19例患者(1例患者撤回知情同意且未完成至少一个完整周期的治疗)、B组20例患者纳入分析。中位随访时间为18.1个月。
与B组相比,A组患者的PFS显著延长,两组中位PFS分别为20.0 vs. 6.0个月(HR=0.335,95%CI: 0.155-0.725),P=0.0038(图1)。初步生存随访显示,A组和B组的中位OS分别为尚未达到 vs. 17.0个月(HR=0.382 ,95% CI: 0.142-1.027),P=0.0479(图2)。A组和B组的ORR分别为47.37% (95% CI: 24.45%-71.14%) vs. 60% (95% CI: 36.05%-80.88%)。
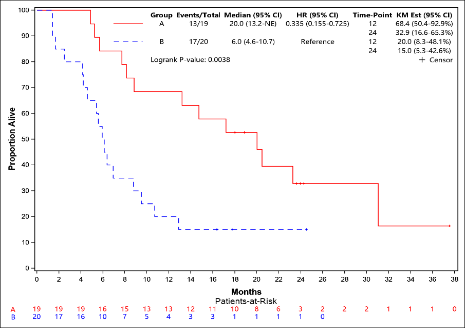
图1. PFS
安全性方面,整体安全性良好。A组和B组分别有12例(63.2%)和11例(55.0%)患者发生了治疗相关不良事件(TRAE)。未发现新的安全信号。
综上,研究者认为,特瑞普利单抗联合CIK和化疗或可作为晚期NSCLC一线治疗的潜在治疗新选择,将进行持续随访以明确长期生存获益情况。

特瑞普利单抗注射液(拓益®)作为我国批准上市的首个国产以PD-1为靶点的单抗药物,获得国家科技重大专项项目支持,并荣膺国家专利领域最高奖项“中国专利金奖”。
特瑞普利单抗至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由公司发起的临床研究。正在进行或已完成的关键注册临床研究在多个瘤种范围内评估特瑞普利单抗的安全性及疗效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。
截至目前,特瑞普利单抗已在中国内地获批10项适应症:用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗(2018年12月);用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗(2021年2月);用于含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗(2021年4月);联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗(2021年11月);联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗(2022年5月);联合培美曲塞和铂类用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌的一线治疗(2022年9月);联合化疗围手术期治疗,继之本品单药作为辅助治疗,用于可切除IIIA-IIIB期非小细胞肺癌的成人患者(2023年12月);联合阿昔替尼用于中高危的不可切除或转移性肾细胞癌患者的一线治疗(2024年4月);联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗(2024年6月);联合注射用紫杉醇(白蛋白结合型)用于经充分验证的检测评估PD-L1阳性(CPS≥1)的复发或转移性三阴性乳腺癌的一线治疗(2024年6月)。2020年12月,特瑞普利单抗首次通过国家医保谈判,目前已有6项获批适应症纳入《国家医保目录(2023年)》,是目录中唯一用于治疗黑色素瘤的抗PD-1单抗药物。2024年4月,香港卫生署药物办公室受理了特瑞普利单抗联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,以及作为单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者的上市许可申请。
在国际化布局方面,特瑞普利单抗已作为首款鼻咽癌药物在美国获得批准,其在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌领域获得美国食品药品监督管理局(FDA)授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定。
2022年12月和2023年2月,欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)分别受理了特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的上市许可申请(MAA)。2023年11月和2024年1月,澳大利亚药品管理局(TGA)和新加坡卫生科学局(HSA)分别受理了特瑞普利单抗联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,以及作为单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者的上市许可申请,其中TGA授予1项孤儿药资格认定,HSA授予1项优先审评认定。
 君实医学发布资料旨在满足医疗卫生专业人士的医学信息需求,仅作为医学和科研参考,无意向您做任何产品的推广,不作为临床用药指导。君实生物不建议以任何与您所在国家所批准的处方信息不符的方式使用本品。诊疗信息请咨询专业医生。
君实医学发布资料旨在满足医疗卫生专业人士的医学信息需求,仅作为医学和科研参考,无意向您做任何产品的推广,不作为临床用药指导。君实生物不建议以任何与您所在国家所批准的处方信息不符的方式使用本品。诊疗信息请咨询专业医生。
 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。

 研究壁报照
研究壁报照


 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键



































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论