
转载自 医脉通肿瘤科
前言
鳞癌是我国食管癌的主要病理类型,约占所有病例的90%以上。目前,手术联合围术期治疗是局晚期食管鳞癌(ESCC)患者的主要治疗模式,为进一步改善预后,针对围术期的优化也在如火如荼地进行中。近期,JUPITER-14研究的前期探索——III期HCHTOG1909研究率先传来重大喜讯:特瑞普利单抗联合化疗新辅助治疗可切除ESCC可提高短期疗效和长期生存,且安全性可控,有望改变ESCC围术期治疗格局。该中期结果已成功发表于《Cancer Communications》(IF=20.1),值此契机,本文特整理文献精华内容,以飨读者。


IO围术期疗效初显

手术是治疗局晚期ESCC患者的“中流砥柱”,然而临床数据显示,即使接受了R0切除与新辅助治疗,仍有约30%的患者在2年内出现远处复发,53%的患者生存期不超过5年。为了进一步增加新辅助治疗后达完全病理缓解(pCR)患者比例,延长总生存期(OS),免疫检查点抑制剂被尝试应用于围术期治疗,并取得了一定成果。其中,我国自主研发的新型重组人源化抗PD-1抑制剂特瑞普利单抗已在II期研究中展现了联合化疗新辅助治疗可切除ESCC的可行性,基于此,进一步验证疗效与安全性的III期HCHTOG1909研究应运而生。

新辅助&辅助治疗,一个都不能少

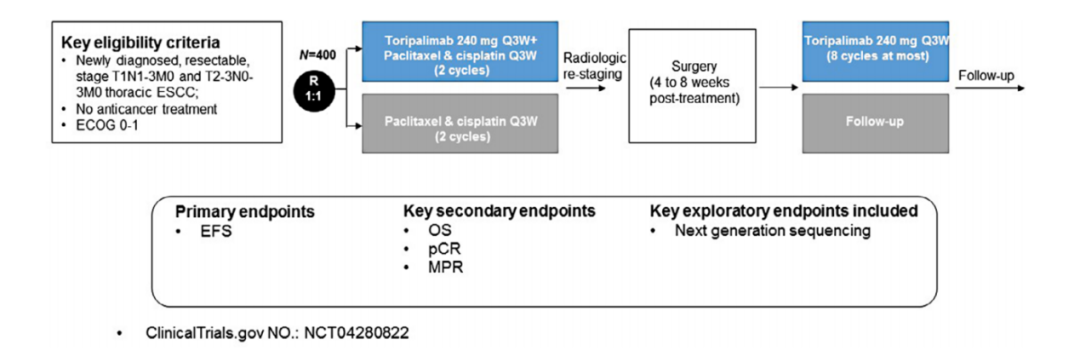
HCHTOG1909研究(NCT04280822)是一项在河南省肿瘤医院进行的单中心、随机、对照III期临床研究,旨在探索新辅助特瑞普利单抗联合化疗对比新辅助化疗治疗可切除局部晚期ESCC的疗效与安全性。
研究计划纳入新诊断可切除的T1N1-3M0或T2-3N0-3M0的ESCC患者,并按1:1随机分为两组,分别在术前接受特瑞普利单抗240mg Q3W、紫杉醇175mg/m2+顺铂75mg/m2 Q3W(2个周期),以及仅接受杉醇175mg/m2+顺铂75mg/m2 Q3W(2个周期),患者均在新辅助治疗后4-8周接受手术,并在术后分别接受特瑞普利单抗240mg Q3W(最多6个月)和随访。研究主要终点是无事件生存期(EFS),主要次要终点为OS、pCR和主要病理缓解(MPR),主要探索性终点包括下一代基因测序。

显著提升,降低疾病进展风险

研究共纳入252例符合条件的患者,中位年龄67岁,其中127例患者进入特瑞普利单抗组,125例患者进入化疗组,两组基线特征均衡。特瑞普利单抗组中115例患者与化疗组中108例患者完成了预设的新辅助治疗。
特瑞普利单抗组中位随访时间为14.0个月,化疗组为11.4个月。两组接受手术的患者均达R0切除。
两组中位EFS均未达到,1年EFS率分别为77.9%与64.3%(HR=0.62;95% CI,0.39-1.00;P=0.05)。
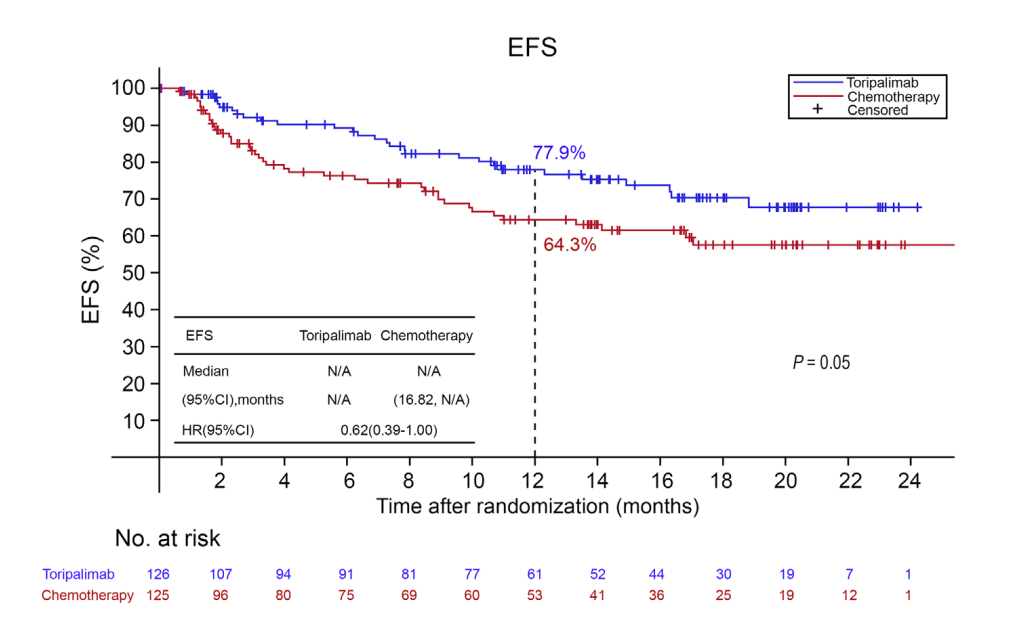
图2. HCHTOG1909研究EFS KM图
特瑞普利单抗组和化疗组的1年OS分别为94.1%与83.0%(HR=0.48;95%CI,0.24-0.97;P=0.037)。值得注意的是,两组OS的KM曲线差异有增大的趋势,提示特瑞普利单抗组患者具有长期的生存获益,且该获益可能会随着时间变大。

图3. HCHTOG1909研究OS KM图
在完成手术的患者中,和化疗组相比,特瑞普利单抗组的pCR率显著更高(18.6% vs 4.6%,P=0.001)。此外,特瑞普利单抗组达到MPR的患者比例也比化疗组更高(29.4% vs 6.8%),即使患者在基线时有淋巴结侵犯。
所有患者均出现不同程度的治疗相关不良反应(TRAE),两组3-4级TRAE无显著差异,分别为12.5%与12.4%,特瑞普利单抗组最常见的3-4级TRAE为低钠血症(1.7%),化疗组为白细胞减少(3.9%)。化疗组中造成手术延迟和/或取消的AE的发生率是特瑞普利单抗组的2倍,分别为1.6%和0.8%。两组大于等于IIIb级的术后Clavien-Dindo并发症的发生率分别为9.8%与6.8%,无显著差异(P=0.460)。特瑞普利单抗联合化疗新辅助治疗方案整体安全性良好。

期待全球首个且唯一ESCC新辅助+辅助免疫治疗注册临床研究读出生存数据

HCHTOG1909研究中期分析显示,特瑞普利单抗联合紫杉醇+顺铂新辅助治疗具有OS获益趋势,pCR率、R0切除率、MPR率等次要终点指标也显示出了一定获益,且安全性与既往结果一致,未增加额外的手术风险。尽管单中心与随访时间较短造成了一定限制,但该中期结果仍为特瑞普利单抗联合化疗新辅助治疗可切除ESCC患者提供了有力的循证医学证据支持。期待未来JUPITER-14最终结果发布,为可切除食管癌患者围术期治疗提供更多治疗选择,建立更有效的治疗模式,带来新的希望与曙光。
参考文献:
Zheng Y, Liang G, Yuan D, et al. Perioperative toripalimab plus neoadjuvant chemotherapy might improve outcomes in resectable esophageal cancer: an interim analysis of a phase III randomized clinical trial. Cancer Commun (Lond). Published online September 2, 2024. doi:10.1002/cac2.12604


声明
 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论