
2024年9月11日,专注于突破性细胞治疗药物研发与产业化的国家高新技术企业博生吉医药科技(苏州)有限公司(以下简称“博生吉”)宣布,与苏州大学唐仲英医学研究院、北京大学肿瘤医院合作研究的新一代通用现货型B7-H3-CAR-γδT细胞治疗多种实体肿瘤的临床前研究成果于近日在国际肿瘤知名学术期刊Cancer Research上线,论文题目是“B7-H3-Targeted CAR-Vδ1T Cells Exhibit Potent Broad-Spectrum Activity Against Solid Tumors”, 姜丽翠博士和游凤涛博士为论文的共同第一作者, 博生吉医药创始人&董事长杨林博士为论文通讯作者。


值得强调的是,B7-H3-CAR-Vδ1T细胞产品是博生吉研发的第一款靶向实体肿瘤、无需基因编辑、且成本高度亲民的通用现货型CAR-Vδ1T细胞药物,也是国际上首次报道的靶向实体肿瘤的基于Vδ1T细胞开发的B7-H3-CAR-γδT细胞产品。
此外,以B7-H3-CAR-Vδ1T细胞产品开发为主要内容的“基于γδT细胞研发平台开发恶性肿瘤的通用型细胞疗法”项目还成功入选了2023年国家生物药技术创新中心细胞疗法“揭榜挂帅”技术攻关“重点项目”,位列重点项目第一名。

在针对血液肿瘤的临床治疗中取得巨大成功的CAR-T细胞疗法,却由于实体肿瘤的复杂性,比如肿瘤免疫抑制微环境、CAR-T细胞归巢障碍、肿瘤抗原异质性等原因,导致CAR-T在针对实体肿瘤的临床治疗中效果并不理想。对于实体肿瘤的治疗,随着ADC和免疫检验点抑制剂等药物在实体瘤治疗上不断取得突破,细胞药物也出现更多类型的产品,比如CAR-NK、TCR-T、TIL等药物类型。
选择Vδ1T细胞来治疗实体肿瘤的主要原因

1
Vδ1T细胞是人体组织的天然驻留免疫细胞,因此具备强大的对实体瘤组织主动归巢和浸润的能力;

2
对于实体肿瘤常见的免疫逃逸机制(低突变负荷、MHC I缺陷等),Vδ1T细胞依然展现出敏感和强大的杀伤能力;

3
Vδ1T细胞兼具先天免疫和适应性免疫的特质,使其在靶向肿瘤的机制上更加丰富,也更有潜力克服肿瘤抗原异质性;

4
越来越多的临床研究发现,实体肿瘤患者的良好预后与Vδ1T细胞的浸润具有显著的相关性,这些发现进一步支持了Vδ1T细胞治疗实体瘤的可行性;

5
Vδ1T细胞不受MHC分子的限制,产生GvHD的风险很低,无须基因编辑敲除TCR即可开发成异体现货型产品。
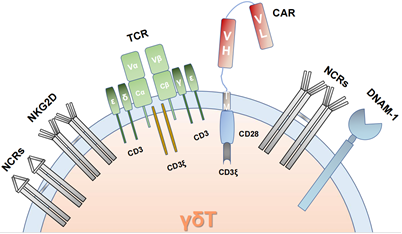
UCAR-Vδ1T细胞
产品优势

01
博生吉建立了cGMP条件下商业化大规模生产UCAR-Vδ1T细胞的先进制备工艺
γδT细胞在健康供者外周中的比例比较低,仅占外周中总的T淋巴细胞1%~5%左右;其中Vδ2T细胞是占比最高的γδT亚群,占外周血中总的γδT细胞的80%以上,也是目前被研究最多的γδT亚群;而Vδ1T细胞在外周中的占比非常低,仅占总T细胞的1%以内,它主要存在于胸腺和黏膜上皮组织中,如皮肤,肠道,脾脏和肝脏等;这也导致在体外大量制备Vδ1T细胞会面临较大的挑战。而博生吉早在2018年就开始布局开发UCAR-Vδ1T产品,六年磨一剑,成功建立了在cGMP条件下商业化大规模生产Vδ1T细胞的独特的制备工艺,并解决了UCAR-Vδ1T细胞的慢病毒转染及冻存工艺的挑战。
02
在多个皮下及原位小鼠异种移植肿瘤模型中,单次静脉给药UCAR-Vδ1T细胞可达到肿瘤完全消退
为了广泛地评估UCAR-Vδ1T细胞在临床前动物模型中的抗实体肿瘤的能力,多个皮下肿瘤模型及原位肿瘤模型,包括神经母细胞瘤、肺癌、胰腺癌、结直肠癌、及乳腺癌等,在单次静脉回输UCAR-Vδ1T细胞后,大部分小鼠的肿瘤完全被清除,平均肿瘤完全清除率可高达80%以上,其中肺癌和乳腺癌模型更是实现了100%的肿瘤清除药效,展现出令人期待的临床应用潜力。



B7-H3-UCAR-Vδ1 T细胞,在原位乳腺癌模型中,单次静脉给药实现了100%的肿瘤快速清除,且表现出优良的PK数据。
03
UCAR-Vδ1T细胞展现出强大的肿瘤归巢能力及良好的安全性
在这次发表的研究成果中,展示了UCAR-Vδ1T细胞对小鼠肿瘤组织的优异浸润能力,以及对各个脏器的显著归巢,而且对正常组织脏器的归巢,未产生病理性损伤。这种对肿瘤和实体脏器的浸润及归巢能力,无疑是治疗实体瘤的的一个核心优势。

B7-H3-UCAR-Vδ1 T细胞,高表达各类趋化因子受体和天然细胞毒受体,展现肿瘤归巢和克服肿瘤抗原异质性的潜力。
开发患者真正获益的创新生物药


本文章的第一作者姜丽翠博士表示:
虽然当前实体肿瘤治疗面临各种挑战,但我们一直致力于实体肿瘤的研发及攻克。通过大量的前期资料调研及最新的临床研究结果,我们发现在众多免疫细胞中Vδ1T细胞本身的特性,使其具备了抗实体肿瘤的潜力。鉴于此,我们研发了一款基于Vδ1T细胞修饰的B7-H3-CAR-Vδ1T 现货通用型细胞药物。我们首先克服了目前在体外大量制备Vδ1T细胞的挑战,成功建立了在cGMP条件下商业化大规模生产UCAR-Vδ1T细胞的独特制备工艺;令人惊喜地是,临床前多种实体肿瘤小鼠模型表明B7-H3-CAR-Vδ1T 在抗实体肿瘤上确实有巨大的潜力,展现出优异的抗肿瘤疗效、强大的肿瘤浸润能力及良好的安全性,因此,我们对未来临床转化也充满了信心与期待。


博生吉新研院院长游凤涛博士表示:

我们非常高兴博生吉国际领先的通用型UCAR-Vδ1T靶向多种实体肿瘤的临床前研究结果发表在Cancer Research杂志上,这也是首次完整披露我们B7-H3-CAR-Vδ1T细胞产品优异的临床前体内外研究数据。B7-H3-CAR-Vδ1T产品,其优异的肿瘤主动归巢能力,使其从众多免疫细胞中脱颖而出,有望成为解决实体瘤细胞治疗的金钥匙。我们将继续前行,不断开发出更多的价格亲民、可及性高、疗效和安全性好的创新生物药,使患者可以真正获益,造福广大患者。



E.N.D

往期文章推荐:
使用双AAV9载体,首款DMD碱基编辑药物完成首例患者给药,开启DMD基因编辑治疗新篇章
投资上亿元,建筑面积超2万平米,云飞医药研发及生产基地开工!
国家三部门联合发文:四个自贸区允许外资企业从事人体干细胞、基因诊断与治疗技术开发和技术应用!
国内首个《基于mRNA-LNP技术的(细胞)免疫治疗产品开发指南》团体标准正式发布
总投资7.7亿、建筑面积超20万平米,国内一细胞与基因治疗产业项目正式开工
全球首例化学诱导细胞来源的外囊泡产品NouvSoma001临床试验启动
国家卫生健康委发布“干细胞研究与器官修复”等共6个重点专项2024年度项目申报指南
中国首个:锐正基因基于非病毒载体的体内基因编辑药物ART001获美国FDA临床试验许可
全球首款,数据亮眼!瑞博生物首次公布靶向FXI的药物RBD4059临床I期数据






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论