
2024年9月10日,吉林省肿瘤医院张良教授在2024 WCLC大会上以迷你口头报告的形式(编号:#MA17.08),现场报告了君实生物自主研发的抗BTLA单抗tifcemalimab联合特瑞普利单抗用于难治性广泛期小细胞肺癌 (ES-SCLC) 的一项I/II期临床研究更新数据,引发国际学者的广泛关注和讨论。报告显示,tifcemalimab联合特瑞普利单抗治疗难治性ES-SCLC具有良好的抗肿瘤活性和耐受性,客观缓解率(ORR)达35.0%,疾病控制率(DCR)为55.0%,中位无进展生存期(PFS)为2.8个月,中位总生存期(OS)达12.3个月。该研究由吉林省肿瘤医院程颖教授和中国医学科学院肿瘤医院王洁教授牵头开展。此前,2023年ASCO大会上首次公布了该研究相关初步数据(点击查看相关报道)。
这项多中心、两队列、开放标签的I/II期临床研究(NCT05000684)旨在晚期肺癌患者中评估tifcemalimab联合特瑞普利单抗治疗的安全性和抗肿瘤活性。其中队列1纳入既往标准治疗失败的转移或复发性非小细胞肺癌患者,队列2纳入标准治疗失败的难治性ES-SCLC患者,分别接受tifcemalimab(200mg,iv,Q3W)联合特瑞普利单抗(240mg,iv,Q3W)治疗,直至疾病进展或出现不可耐受的毒性。主要终点包括安全性和研究者根据RECIST v1.1标准评估的ORR,次要终点包括DCR、缓解持续时间(DoR)、PFS和OS。此次大会披露了队列2 tifcemalimab联合特瑞普利单抗用于难治性ES-SCLC的更新数据。
自2021年8月27日至2023年1月13日,研究共入组43例难治性ES-SCLC患者。中位年龄为59.0(范围:38-75)岁,79.1%(34例)为男性患者。44.2%(19例)患者既往接受了≥2线系统治疗,32.56%(14例)患者既往接受过免疫治疗。截至2024年3月14日,中位随访时间为11.17个月。
Tifcemalimab联合特瑞普利单抗具有良好的抗肿瘤活性,ORR达35.0%

表1. 疗效数据
生物标志物分析显示,HVEM表达与生存改善无显著相关性
研究者进行了HVEM检测以探索生物标志物,26例患者中7例为HVEM阳性(阳性率26.9%)。初步分析结果显示,在HVEM阳性的患者中观察到更高的ORR(HVEM阳性患者 vs. HVEM阴性患者:57.1% vs. 47.1%)(图1)。进一步的PFS(图2A)和OS(图2B)相关性分析显示,与HVEM阴性患者相比,HVEM阳性患者的PFS和OS无显著差异。

图1. 目标病灶较基线的最大肿瘤消退率

图2. HVEM表达阳性或阴性患者的PFS(A)和OS(B)
Tifcemalimab联合特瑞普利单抗的耐受性良好,安全性可管理
39例(90.7%)患者发生了治疗期间出现的不良事件(TEAE),其中≥3级TEAE发生率为39.5%。研究期间,未发生任何输液反应,也未发生因TEAE导致的停药。18例(41.9%)患者发生了免疫相关不良事件(irAE),其中4例患者发生了≥3级irAE(表2)。
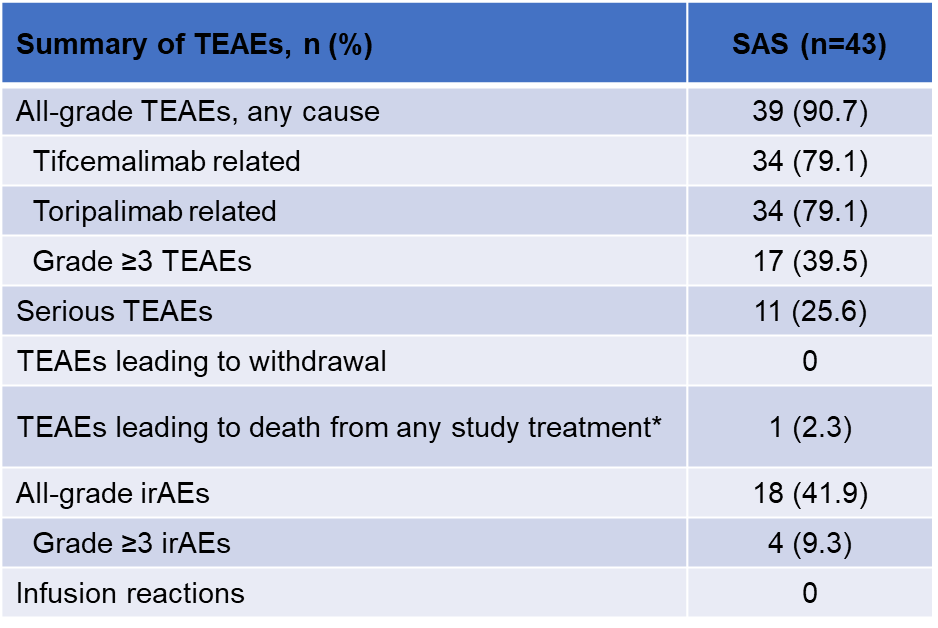
表2. TEAE发生情况
综上,tifcemalimab联合特瑞普利单抗用于难治性ES-SCLC显示出良好的抗肿瘤活性和耐受性,研究结果支持tifcemalimab联合特瑞普利单抗作为难治性ES-SCLC患者的潜在治疗选择,值得进行进一步临床研究评估。

Tifcemalimab(TAB004/JS004)是君实生物自主研发的全球首个进入临床开发阶段(first-in-human)的抗肿瘤重组人源化抗BTLA(B和T淋巴细胞衰减因子)单克隆抗体。目前,tifcemalimab已获准进入III期临床研究阶段,另有多项联合特瑞普利单抗的Ib/II临床研究正在中国和美国同步开展中,覆盖多个瘤种。
Tifcemalimab所针对的BTLA靶点于2003年发现,为CD28受体家族成员1。它具有单个IgSF V细胞外域,其序列与其他CD28家族分子(例如PD-1和CTLA-4)具有相似性。
BTLA在T和B淋巴细胞以及树突状细胞亚群上表达。BTLA与其配体HVEM(Herpes virus entry mediator,疱疹病毒侵入介质)的相互作用于2005年被发现,HVEM是在造血系统中广泛表达的TNF受体,被确定为BTLA的配体2。
BTLA是一种免疫球蛋白相关性膜蛋白,其蛋白结构类似于跨膜受体CTLA-4和PD-1。在正常生理情况下,BTLA与其配体HVEM结合后,可以抑制淋巴细胞的过度活化,防止免疫系统对自身的损伤2。
Tifcemalimab通过结合BTLA,阻断HVEM-BTLA的相互作用,从而阻断BTLA介导的抑制性信号通路,最终达到激活肿瘤特异淋巴细胞的作用。
【参考文献】
Watanabe, N., Gavrieli, M., Sedy, J.R., Yang,J., Fallarino, F., Loftin, S.K., Hurchla, M.A., Zimmerman, N., Sim, J., Zang, X., et al. (2003). BTLA is a lymphocyte inhibitory receptor with similarities to CTLA-4 and PD-1. Nat Immunol 4, 670-679.
Sedy, J.R., Gavrieli, M., Potter, K.G., Hurchla, M.A., Lindsley, R.C., Hildner, K., Scheu, S., Pfeffer, K., Ware, C.F., Murphy, T.L., et al. (2005). B and T lymphocyte attenuator regulates T cell activation through interaction with herpesvirus entry mediator. Nat Immunol 6, 90-98.
特瑞普利单抗注射液(拓益®)作为我国批准上市的首个国产以PD-1为靶点的单抗药物,获得国家科技重大专项项目支持,并荣膺国家专利领域最高奖项“中国专利金奖”。
特瑞普利单抗至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖超过15个适应症的40多项由公司发起的临床研究。正在进行或已完成的关键注册临床研究在多个瘤种范围内评估特瑞普利单抗的安全性及疗效,包括肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等。
截至目前,特瑞普利单抗已在中国内地获批10项适应症:用于既往接受全身系统治疗失败的不可切除或转移性黑色素瘤的治疗(2018年12月);用于既往接受过二线及以上系统治疗失败的复发/转移性鼻咽癌患者的治疗(2021年2月);用于含铂化疗失败包括新辅助或辅助化疗12个月内进展的局部晚期或转移性尿路上皮癌的治疗(2021年4月);联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗(2021年11月);联合紫杉醇和顺铂用于不可切除局部晚期/复发或远处转移性食管鳞癌患者的一线治疗(2022年5月);联合培美曲塞和铂类用于表皮生长因子受体(EGFR)基因突变阴性和间变性淋巴瘤激酶(ALK)阴性、不可手术切除的局部晚期或转移性非鳞状非小细胞肺癌的一线治疗(2022年9月);联合化疗围手术期治疗,继之本品单药作为辅助治疗,用于可切除IIIA-IIIB期非小细胞肺癌的成人患者(2023年12月);联合阿昔替尼用于中高危的不可切除或转移性肾细胞癌患者的一线治疗(2024年4月);联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗(2024年6月);联合注射用紫杉醇(白蛋白结合型)用于经充分验证的检测评估PD-L1阳性(CPS≥1)的复发或转移性三阴性乳腺癌的一线治疗(2024年6月)。2020年12月,特瑞普利单抗首次通过国家医保谈判,目前已有6项获批适应症纳入《国家医保目录(2023年)》,是目录中唯一用于治疗黑色素瘤的抗PD-1单抗药物。2024年4月,香港卫生署药物办公室受理了特瑞普利单抗联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,以及作为单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者的上市许可申请。
在国际化布局方面,特瑞普利单抗已作为首款鼻咽癌药物在美国获得批准,其在黏膜黑色素瘤、鼻咽癌、软组织肉瘤、食管癌、小细胞肺癌领域获得美国食品药品监督管理局(FDA)授予2项突破性疗法认定、1项快速通道认定、1项优先审评认定和5项孤儿药资格认定。
2022年12月和2023年2月,欧洲药品管理局(EMA)和英国药品和保健品管理局(MHRA)分别受理了特瑞普利单抗联合顺铂和吉西他滨用于局部复发或转移性鼻咽癌患者的一线治疗以及联合紫杉醇和顺铂用于不可切除局部晚期/复发或转移性食管鳞癌患者的一线治疗的上市许可申请(MAA)。2023年11月和2024年1月,澳大利亚药品管理局(TGA)和新加坡卫生科学局(HSA)分别受理了特瑞普利单抗联合顺铂/吉西他滨作为转移性或复发性局部晚期鼻咽癌成人患者的一线治疗,以及作为单药治疗既往含铂治疗过程中或治疗后疾病进展的复发性、不可切除或转移性鼻咽癌的成人患者的上市许可申请,其中TGA授予1项孤儿药资格认定,HSA授予1项优先审评认定。

君实医学发布资料旨在满足医疗卫生专业人士的医学信息需求,仅作为医学和科研参考,无意向您做任何产品的推广,不作为临床用药指导。君实生物不建议以任何与您所在国家所批准的处方信息不符的方式使用本品。
 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键
<END>
*版权声明:本网站所转载的文章,均来自互联网,旨在传递更多信息。鉴于互联网的开放性和文章创作的复杂性,我们无法保证所转载的所有文章均已获得原作者的明确授权。如果您是原作者或拥有相关权益,请与我们联系,我们将立即删除未经授权的文章。本网站转载文章仅为方便读者查阅和了解相关信息,并不代表我们认同其观点和内容。读者应自行判断和鉴别转载文章的真实性、合法性和有效性。







 觉得有用,请“分享 点赞 在看”一连三键
觉得有用,请“分享 点赞 在看”一连三键



































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论