9月9日,Summit Therapeutics公司在国际肺癌研究协会(IASLC)2024年世界肺癌大会(WCLC 2024)上公布了3期临床试验HARMONi-2的主要分析数据。试验结果显示,潜在“first-in-class”双特异性抗体ivonescimab与获批重磅免疫检查点抑制剂相比,作为一线疗法,显著降低了PD-L1阳性晚期非小细胞肺癌(NSCLC)患者疾病进展或死亡的风险。行业媒体Fierce Pharma发表的文章表示,这一结果具有改变NSCLC一线标准治疗的潜力。HARMONi-2为一项头对头的3期临床试验,PD-L1阳性晚期NSCLC患者接受ivonescimab单药治疗,活性对照组为pembrolizumab单药治疗。HARMONi-2是一项在中国进行的单地区、多中心、双盲3期研究,由Summit Therapeutics合作伙伴康方生物主办,数据由康方生物生成和分析。汉康资本于2015年参与康方生物A轮融资,并在后续轮次继续支持。
在HARMONi-2的主要分析中,ivonescimab单药治疗在独立影像学审评委员会(IRRC)评估的主要终点——无进展生存期(PFS)上显示出统计学显著的改善,与活性对照组相比,降低患者疾病进展或死亡风险49%(HR=0.51,95% CI:0.38,0.69;p<0.0001)。
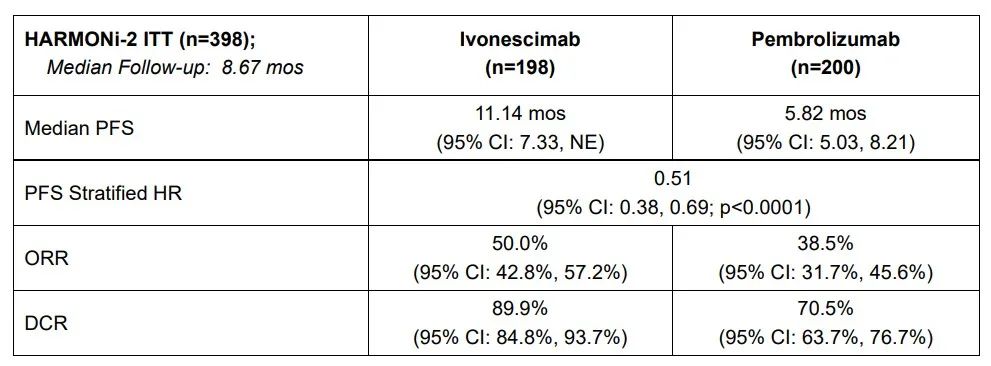
▲HARMONi-2的主要分析结果(图片来源:参考资料[1])
对患者亚群的分析显示出在患者亚群中(包括PD-L1低表达组、PD-L1高表达组、鳞状和非鳞状组织类型以及其他高风险患者),ivonescimab均表现出临床显著的益处。根据RECIST v1.1标准评估,ivonescimab治疗的患者总缓解率(ORR)和疾病控制率(DCR)均高于活性对照组。目前总生存期的数据尚未成熟,未来将进行评估。
▲Ivonescimab在不同患者亚群中的表现(图片来源:参考资料[1])
Ivonescimab展现了可接受且可控制的安全性,与之前的研究结果一致。因治疗相关不良事件(TRAEs)停用ivonescimab的患者有3例(1.5%),而活性对照组这一数值为6例(3.0%)。在这项研究中,ivonescimab组有1例患者因TRAEs死亡,而活性对照组有2例患者死亡。Ivonescimab治疗组最常见的治疗相关不良事件包括蛋白尿(3级及以上:ivonescimab组3.0%;活性对照组0.0%)、高血压(3级及以上:ivonescimab组5.1%;活性对照组0.5%),以及实验室检测异常,包括转氨酶升高、高胆固醇血症、贫血和胆红素升高。接受ivonescimab治疗的患者中有7.1%出现3级或以上的免疫相关不良事件,而活性对照组患者中该比例为8.0%。在ivonescimab单药治疗组中,可能与血管内皮生长因子(VEGF)相关的3级或以上不良事件发生率为10.2%,而活性对照组为1.0%,所有这些事件均为3级。值得注意的是,在ivonescimab组中有两例患者(均为非鳞状组织类型)出现3级出血事件,而活性对照组中有一例患者出现该类事件。
▲Ivonescimab的安全性特征数据(图片来源:参考资料[1])
基于HARMONi-2的结果,Summit宣布计划在2025年初启动HARMONi-7研究。HARMONi-7计划为一项多地区3期临床试验,将比较ivonescimab单药治疗与pembrolizumab单药治疗在PD-L1高表达的转移性非小细胞肺癌患者中的疗效。
HARMONi-2数据之外,研究人员还报告了另一项在中国开展的单地区、多中心、开放标签2期研究AK112-205的结果。这项研究招募了II期或III期可切除NSCLC患者。该研究旨在评估患者在手术切除前接受ivonescimab单药或ivonescimab联合化疗治疗,随后术后继续接受ivonescimab单药治疗的效果。由于数据的成熟度和数据截止时间,本次报告的结果仅限于新辅助(术前)部分的临床试验。在数据截止时,新辅助治疗组中有49名患者接受了ivonescimab联合化疗治疗,其中39名患者完成了手术。
在接受ivonescimab联合化疗新辅助治疗并完成手术的39名患者中,71.8%的患者实现了主要病理学缓解(MPR),43.6%的患者实现了病理学完全缓解(pCR)。在该组的49名患者中,中位随访时间8.9个月时,中位无事件生存期(EFS)尚未达到。12个月的无事件生存率为80.3%(95% CI:59.6,91.1)。与全球关键性研究中的历史数据相比,这些结果令人鼓舞。安全性方面,在新辅助治疗阶段接受ivonescimab联合化疗治疗的49名患者中,32.7%的患者出现了3级或以上不良事件,有1名患者出现了与治疗相关的严重不良事件。没有TRAEs导致手术延误或取消,亦没有患者因TRAEs死亡。
Ivonescimab为靶向PD-1和VEGF的双特异性抗体,最初由康方生物开发,可阻断PD-1与PD-L1和PD-L2的结合,同时阻断VEGF与VEGF受体的结合。康方生物公开资料指出,鉴于VEGF和PD-1在肿瘤微环境中的共表达,与联合疗法相比,该产品作为单一药物同时阻断这两个靶点,可能会更有效地阻断这两个通路,增强抗肿瘤活性。此外,与联合疗法相比,ivonescimab安全性优势显著,与VEGF靶点相关的毒副作用大幅度降低。康方生物曾于2022年12月以5亿美元首付款、总交易额高达50亿美元的合作方案,授予Summit Therapeutics于美国、加拿大、欧洲和日本对ivonescimab的开发和商业化独家许可权。2024年6月,双方签署补充许可协议,在原有合作协议下拓展ivonescimab的许可市场范围,加速ivonescimab在全球各地区的监管注册及商业化。Summit将新增获得ivonescimab在中美、南美、中东和非洲等相关市场的开发及商业化独家权益。康方生物将获得7000万美元的首付款和里程碑款,以及ivonescimab在新增许可市场的销售提成。[1] Ivonescimab Monotherapy Reduced the Risk of Disease Progression or Death by 49% Compared to Pembrolizumab Monotherapy in First-Line Treatment of Patients with PD-L1 Positive Advanced NSCLC in China. Retrieved September 8, 2024, from https://www.smmttx.com/wp-content/uploads/2024/09/2024_PR_0908_WCLC-HARMONi-2-Data-_-FINAL-7.pdf[2] Detailed data show Summit therapy beat Merck blockbuster Keytruda in late-stage lung cancer trial. Retrieved September 8, 2024, from https://www.statnews.com/2024/09/08/summit-therapeutics-ivonescimab-lung-cancer-merck-keytruda-results/[3] Akeso, Summit's PD-1 bispecific crushes Merck's Keytruda in study, signaling potential new standard in lung cancer. Retrieved September 8, 2024, from https://www.fiercepharma.com/pharma/akeso-summit-pd-1-bispecific-crushes-merck-keytruda-new-standard-lung-cancer
康方生物(9926.HK)是一家集研究、开发、生产及商业化全球首创或同类最佳创新生物新药于一体的领先企业。自2012年成立以来,公司打造了独有的端对端康方全方位新药研究开发平台(ACE Platform),建立了以Tetrabody双特异性抗体开发技术、抗体偶联(ADC)技术平台、mRNA技术平台及细胞治疗技术为核心的研发创新体系,国际化标准的GMP生产体系和运作模式先进的商业化体系,成为了在全球范围内具有竞争力的生物医药创新公司。
公司已开发了50个以上用于治疗肿瘤、自身免疫、炎症、代谢疾病等重大疾病的创新候选药物,19个候选药已进入临床(包括8个多特异性抗体),4个新药已在商业化销售,4个新药多个适应症的上市申请处于审评审批阶段。
2021年8月,公司自主研发的差异化PD-1单抗安尼可®获批上市;2022年6月,公司全球首创的PD-1/CTLA-4双抗开坦尼®获批上市,成为全球首个获批的肿瘤免疫治疗双抗新药,也是中国第一个双特异性抗体新药。2024年1月,卡度尼利联合化疗一线治疗晚期胃或胃食管结合部腺癌的新药上市许可申请(NDA)已获受理。2024年5月,公司另一全球首创双抗新药依达方®获得中国国家药品监督管理局批准上市,成为全球首个获批的PD-1/VEGF双特异性抗体。此前,2022年12月,公司对外许可了的依达方®部分海外权益,并以50亿美金+销售提成的合作方案创下了彼时中国单药对外许可的最高交易金额纪录,创新产品国际化步伐提速。
康方生物期望通过高效及突破性的研发创新,开发国际首创及同类药物最佳疗法的新药,成为全球领先的生物制药企业。
汉康资本是一家专注于医药健康产业的风险投资基金。基金以“赋能医药创新,守护人类健康”为使命,携手一流科学家和企业家共同开发治疗重大疾病的突破性新药。汉康资本立足中国,放眼世界,投资的多家企业已成长为行业领先企业,如康方生物(09926.HK)、诺诚健华(09969.HK,688428.SH)、康诺亚生物(02162.HK)、微芯生物(688321.SH)、和誉医药(02256.HK)、奥浦迈(688293.SH)等。








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论