
来源:药渡
撰文:balabala 编辑:维他命
全球肥胖问题的现状十分严峻,据《柳叶刀》发布的研究报告显示,2022年全球肥胖症人口高达10亿多人,自1990年以来,全世界成年人肥胖症人数增加了一倍多,儿童和青少年(5至19岁)肥胖症人数增加了三倍。预测到2035年,全球超重和肥胖人口将会超过40亿,这将对公共卫生系统带来巨大挑战。减肥药物市场的潜在规模巨大,据统计,2016-2020年全球减肥药物市场规模由18.0亿美元增长至26.0亿美元,复合年均增长率为7.6%。此外,财通证券研报预测,到2025年,全球减肥药市场将达到63亿美元,中国的减肥药市场将达到53亿元。面对减肥药物市场的高需求,药企正通过扩大产能、推进新适应症的申请来解决供应问题。然而,市场竞争也在加剧,随着专利到期和新药的不断研发,市场竞争日益加剧,众多企业纷纷布局这一赛道,试图瓜分这一新兴市场。Viking Therapeutics的VK2735治疗肥胖症的二期VENTURE研究达到主要终点和所有次要终点,与基线相比,接受每周剂量VK2735的患者在13周后的平均体重下降14.7%,具有统计学意义。在整个研究过程中,体重逐渐下降,在13周时没有观察到体重减轻的平台期,并且安全性和耐受性良好(图1)。Viking已收到美国FDA的书面回复,决定将其提前推进到三期临床试验阶段。此外,口服片剂形式的VK2735在1期研究中也显示出良好的安全性和耐受性,以及积极的临床效果趋势。Viking预计将在今年第四季度启动这一项目的2期试验。

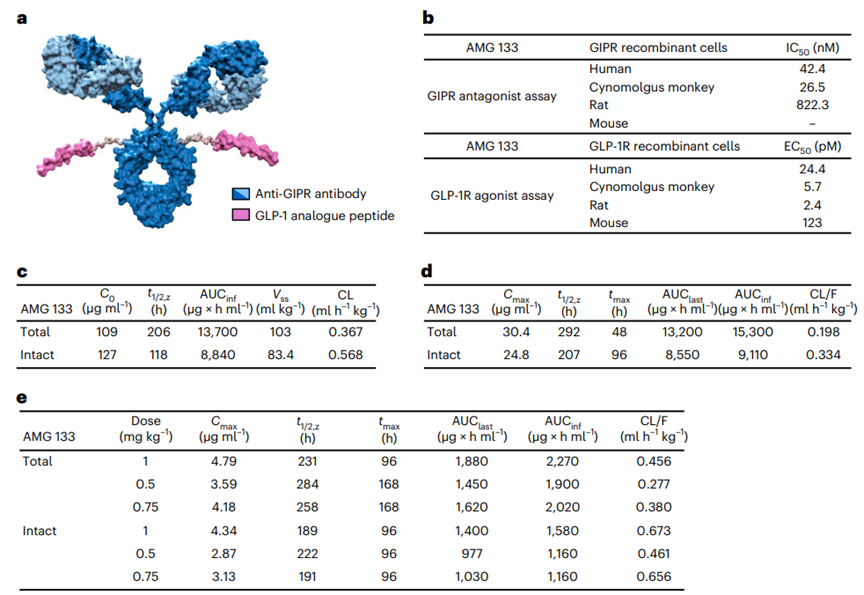
图1. 观察到每周服用一次VK2735 13周后体重的变化Amgen的研究人员在Nature Metabolism上发表了在研减肥疗法AMG 133的临床前研究和1期临床试验结果。表明新开发的GIPR/GLP-1R双特异性分子——AMG 133,能够有效减轻雄性肥胖小鼠和食蟹猴体重并改善代谢健康。临床试验结果表明:肥胖患者只需每月一针,接受高剂量AMG 133治疗85天后,体重可降低14.5%(约26斤),且在停药后150天,仍可维持体重降低11.2%(图2)。图2. AMG 133的结构和体外活性数据
甘李药业GLP-1受体激动剂双周制剂GZR18注射液在IIb期临床试验中取得积极结果。肥胖和超重受试者接受每两周一次12mg、18mg、24mg、48mg以及每周一次24mg GZR18注射液治疗30周后,平均体重较基线变化百分比分别为-11.15%、-13.22%、-14.25%、-17.29%和-17.78%,安慰剂组为-0.99%;且30周时,GZR18注射液组受试者体重仍在持续下降。这一数据要明显优于司美格鲁肽最大剂量2.4mg 48周下减重-14.4%和替尔泊肽最大剂量15mg 72周减重-20.1%,竞争势头强劲。博瑞医药研究人员及其合作团队7月19日在Scientific Reports期刊上发表了双GLP-1/GIP受体激动剂BGM0504的分子设计策略和实验结果,在体内外实验研究中发现,BGM0504分子设计更优,BGM0504相比Tirzepatide在GLP-1R/GIPR上提升到3倍的激动活性,同时保持了其在血浆中的延长半衰期(图3)。BGM0504作为一种用于治疗糖尿病和肥胖症的多肽药物,具有良好的安全性和有效性。

图3. Tirzepatide和BGM0504的结构分析对比和优化策略8月26日,博瑞医药披露BGM0504注射液相关临床数据,相关信息显示,公司自主研发的GLP-1(胰高血糖素样肽1)和GIP(葡萄糖依赖性促胰岛素多肽)受体双重激动剂——BGM0504注射液在中国2型糖尿病受试者中开展的II期临床试验(CTR202232464)达到首要终点和关键次要终点,展现出降糖/减重的综合代谢获益。试验结果显示,BGM0504在降糖效果和减重效果优于司美格鲁肽和替尔泊肽,在这场头对头PK中展现出了其卓越的治疗潜力和市场竞争力(图4)。
图4. 博瑞医药披露BGM0504注射液相关临床数据公告2024年7月9日,诺和诺德宣布即将在2024年欧洲糖尿病研究协会(EASD)年会的摘要中,公布其口服GLP-1和胰淀素的长效共激动剂amycretin的详细试验结果。分析显示,试验12周时,接受最高剂量amycretin受试者的体重降幅高达13.1%(图5),且受试者的体重下降尚未达到平台期,表明患者可能通过延长治疗达成体重进一步下降。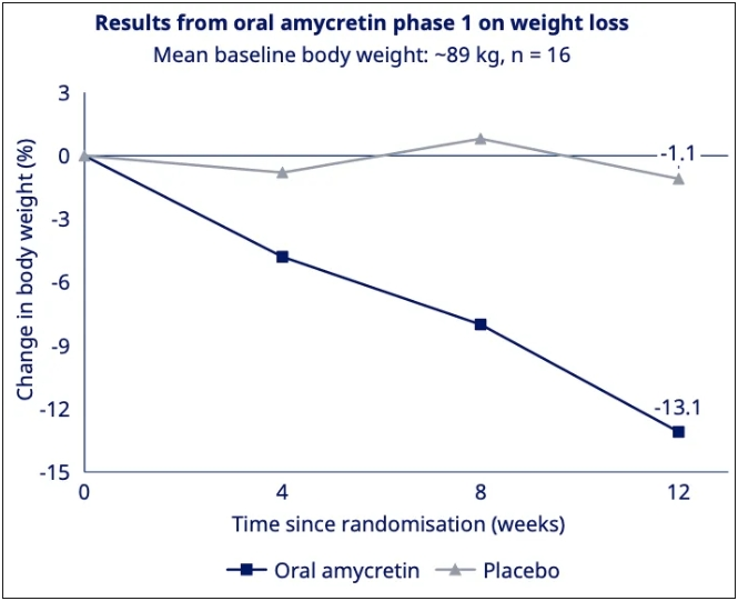
图5. Amycretin在1期试验中的减重效果
7月17日,罗氏宣布其在研减重口服小分子CT-996 I 期临床试验中的两个治疗组取得了积极结果。数据显示,肥胖且无2型糖尿病的受试者在接受CT-996治疗4周后,经安慰剂校正的平均体重减轻幅度达到了-6.1%(p<0.001),具有临床意义。2024年1月,国家药品监督管理局(NMPA)批准了诺和诺德公司开发的GLP-1受体激动剂司美格鲁肽注射液在中国的上市申请,用于成人2型糖尿病治疗,但因其显著的减重效果,已获得FDA批准作为减肥药上市。其商品名Wegovy在美国用于非糖尿病成年人减肥的适应症于2021年获批,而在中国,司美格鲁肽注射液“减肥版”于2024年6月25日获得国家药监局批准(图6)。
2024年5月21日,国家药品监督管理局(NMPA)批准了礼来公司开发的GLP-1/GIP受体双重激动剂替尔泊肽(Tirzepatide)用于成人2型糖尿病患者的血糖控制。2024年7月19日,国家药监局批准了替尔泊肽用于改善成人肥胖或超重患者的体重管理,该适应症适用于在低热量饮食和增加运动基础上进行长期体重管理的患者。为瑞士Hoffmann La Roche公司研发,于1998年在新西兰首次上市 ,1999年在美国获得FDA批准上市。2001年在我国获得NMPA批准上市,2007年正式批准为减肥OTC(非处方药),其作用机制是抑制肠道内油脂的吸收,从而减少热量摄入达到减肥目的。但奥利司他存在副作用,如胃肠排气增多、大便次数增多、脂肪泻等。作为GLP-1类药物,利拉鲁肽注射液的肥胖或超重适应症曾于2014年获得FDA批准,2024年6月25日,中国生物制药的利拉鲁肽注射液在中国获批用于成人二型糖尿病治疗。2016年12月13日获批上市,用于成人2型糖尿病患者控制血糖,并且在单用二甲双胍血糖控制不佳的患者中具有显著疗效。2023年7月国内首款减重适应症的原创新药贝那鲁肽注射液获得国家药监局批准上市(图7)。
随着肥胖率的上升和对健康生活方式的追求,全球减肥药物市场预计将持续扩大。GLP-1受体激动剂类药物因其在减重和降糖方面的显著效果而成为研究的热点。特别是司美格鲁肽和替尔泊肽等药物,已经展现出超越传统减肥药物的减重效果。随着GLP-1类药物的火热,众多企业纷纷布局这一赛道,未来市场竞争将愈发激烈。同时,新进入者将寻求在这个大市场中分得一杯羹。据预测,到2030年,GLP-1类药物的市场价值可能超过1000亿美元,其中糖尿病和肥胖症的治疗将对其产生同等的推动作用。未来的减肥药物将趋向于与生活方式干预(如饮食、运动)、心理干预等综合治疗方案相结合,形成全面的体重管理方案。此外,基于遗传学和微生物组学的个体化治疗方案将成为研究热点,通过精准医疗实现更有效的减肥效果。总之,减肥药物行业正处于一个快速发展的时期,随着新药的研发、市场规模的扩大、治疗策略的多元化以及政策和监管的逐步完善,未来的减肥药物将更加安全、有效,并能够满足不同患者的需求。1、Viking Therapeutics Announces Positive Top-Line Results from Phase 2 VENTURE Trial of Dual GLP-1/GIP Receptor Agonist VK2735 in Patients with Obesity2、A GIPR antagonist conjugated to GLP-1 analogues promotes weight loss with improved metabolic parameters in preclinical and phase 1 settings3、GZR18, a novel long-acting GLP-1 analog, demonstrated positive in vitro and in vivo pharmacokinetic and pharmacodynamic characteristics in animal models.4、Molecular dynamics-guided optimization of BGM0504 enhances dual-target agonism for combating diabetes and obesity5、Safety, tolerability and weight reduction findings of oral amycretin: a novel amylin and glucagon-like peptide-1 receptor co-agonist, in a first-in-human study.6、[Ad hoc announcement pursuant to Art. 53 LR] Roche announces positive Phase I results of its oral GLP-1 receptor agonist CT-996 for the treatment of people with obesity.本公众号发布的各类文章重在分享,对文中陈述、观点判断保持中立,不对所包含内容的准确性、可靠性或完整性提供任何明示或暗示的保证。尊重原创,如有侵权,请联系我们,我们将会在24小时内删除。











































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论