大B细胞淋巴瘤(LBCL)是一种高度异质性的血液系统恶性肿瘤,包括弥漫性大B细胞淋巴瘤(DLBCL)、原发性纵隔B细胞淋巴瘤(PMBCL)和转化型滤泡淋巴瘤(TFL)[1]。LBCL的一线治疗方案通常采用R-CHOP方案[2],然而仍有近40%的LBCL患者在一线治疗后出现复发或耐药,进展为复发/难治性大B细胞淋巴瘤(R/R LBCL)[3]。
Axicabtagene ciloleucel(Axi-cel)是一种抗CD19自体嵌合抗原受体T(CAR-T)细胞疗法。2023年第65届美国血液学会(ASH)年会以壁报形式首次公布了美国淋巴瘤CAR-T联盟的Axi-cel真实世界研究长达5年的随访数据[4]。近期,《J Clin Oncol》期刊发表了该研究的全文,更加详尽的展示了真实世界中Axi-cel治疗R/R LBCL患者的5年随访结局[5]。
Jain MD, Spiegel JY, Nastoupil LJ, et al. Five-Year Follow-Up of Standard-of-Care Axicabtagene Ciloleucel for Large B-Cell Lymphoma: Results From the US Lymphoma CAR T Consortium[J]. J Clin Oncol. 2024:JCO2302786. DOI: 10.1200/JCO.23.02786.
真实世界研究中,Axi-cel治疗R/R LBCL的长期疗效与关键注册临床试验ZUMA-1[6]的报告结果一致,均在5年随访时观察到持续和持久的反应。
真实世界研究中,Axi-cel治疗R/R LBCL的5年OS率为40.3%,达到CR的患者具有更长的OS。
研究方法
本研究是一项真实世界回顾性研究,从美国十七个CAR-T治疗中心纳入可接受单采的患者,并制备Axi-cel。可接受单采的疾病状态包括:1)原发难治性,即治疗结束时从未达到完全缓解(CR);2)非原发难治性、且接受最近一次治疗后没有缓解;3)复发性,指接受最近一次治疗后有缓解,但后来已复发或疾病进展(PD)。根据相关指南对CAR-T细胞毒性进行分级和管理。
根据Lugano 2014淋巴瘤治疗反应评价标准评估治疗反应[7]。此外,不良事件分类中,严重感染定义为需住院治疗或静脉注射抗生素。
研究结果
患者基线特征
截止至2018年9月30日,共有275例患者接受Axi-cel回输(表1)。
表1 接受Axi-cel回输的患者基线特征

数据截止时,82%的患者实现缓解
本研究的随访数据收集至2023年7月15日。中位随访时间为58个月(范围,0.16个月-68.7个月)时,接受Axi-cel治疗患者的客观缓解率(ORR)为82%,其中,64%的患者达到CR,18%为部分缓解(PR),3%为疾病稳定(SD),以及14%为疾病进展(PD)。
5年PFS率达28.5%,达到CR的患者预后较好
数据截止时,接受Axi-cel治疗患者的中位PFS时间为8.7个月(95% CI,5.9个月-16.6个月),1年、3年和5年的PFS率分别为47.3%(95% Cl,41.3%-53%)、36.1%(95% Cl,30.4%-41.8%)和28.5%(95% Cl,23.0%-34.2%)(图1)。

图1 接受Axi-cel治疗的所有患者的PFS率
随访期间,共发生了191例PFS事件,其中151例为进展事件和40例为非复发死亡(NRM)。未达到CR的患者预后较差(图2)。

图2 按缓解情况评估的PFS率
根据Axi-cel治疗后前6个月的缓解来评估最后随访时的PFS率和OS率(图3)。在3个月时达到CR的患者中,最后随访时PFS率和OS率分别为46.6%(95% CI,36.4%-54.5%)和61.1%(95% CI,51.5%-69.4%)。对于6个月时达到CR的患者,最后随访时PFS率和OS率分别为54.4%(95% CI,44.1%-63.6%)和64.7%(95% CI,54.3%-73.3%)。

图3 在Axi-cel治疗后达到CR与最后一次随访时的临床结局之间的相关性可视化分析
5年OS率为40.3%,达到CR的患者具有更长的OS
接受Axi-cel治疗患者的中位OS时间为34.9个月(95% CI,23.4个月-44.8个月),1年、3年和5年的OS率分别为68.6%(95% Cl,62.8%-73.8%)、49.1%(95% CI,42.9%-54.9%)和40.3%(95% CI,34.2%-46.4%)(图4)。实现CR的患者具有更长的OS,而PD的患者的生存情况极差(图5)。

图4 接受Axi-cel治疗的所有患者的OS率
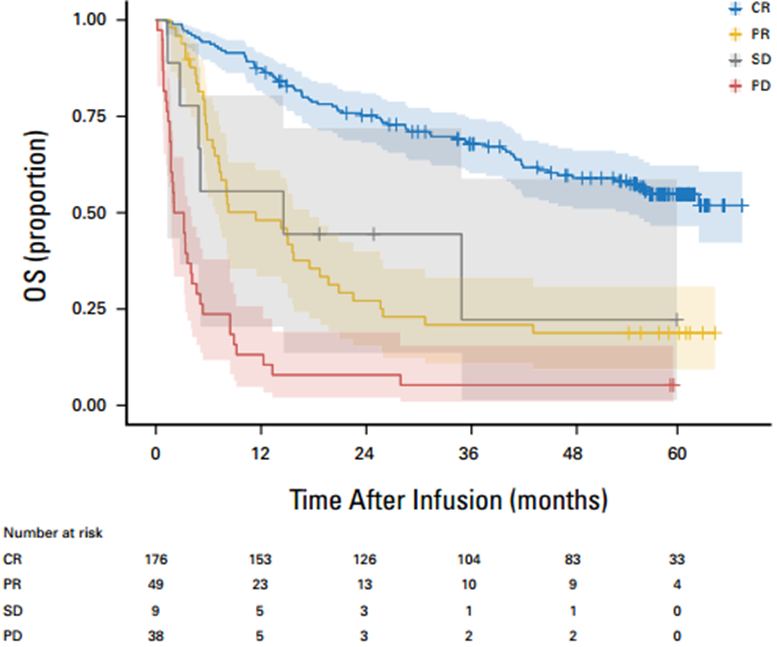
图5 按缓解情况评估的OS率
此外,5年淋巴瘤特异性生存率为53.3%(95% CI, 46.8%-59.3%)(图6),与既往报道的ZUMA-1研究结果相似(51.1%)。

图6 接受Axi-cel治疗的所有患者的疾病特异性生存率(不包含死于NRM事件的患者)
Axi-cel治疗的LBCL患者长期生存面临的挑战
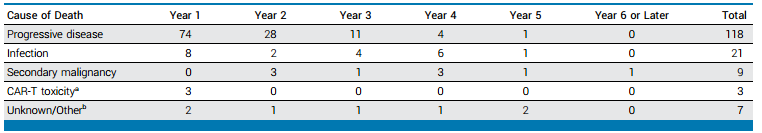
随访期间,在接受Axi-cel治疗的所有患者人群中,共发生了158例死亡,其中118例死于淋巴瘤复发,40例死于NRM事件。总体而言,5年NRM率为16.2%。复发通常发生于接受CAR-T细胞疗法后的早期随访期间,随着时间的推移,复发将减少,但仍会发生NRM事件。
表2 接受Axi-cel治疗后按年分列的死亡原因
根据基线特征的单因素分析中,年龄≥60岁与NRM相关(OR,4.5 [95% CI, 2.1-10.9];p<0.001)。既往多因素分析指出,年龄与OS不相关,但老年患者晚期NRM风险较高,提示接受CAR-T细胞疗法的患者的死亡原因可能随年龄不同而异。尽管年龄≥60岁的患者淋巴瘤进展发生率较低(p=0.02),但与年轻患者相比,NRM风险升高(p<0.001,图7)。
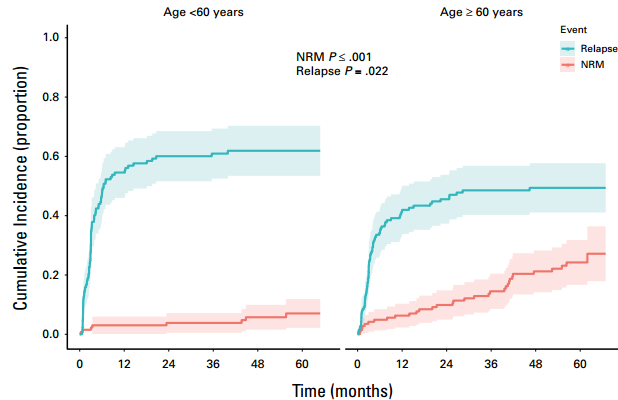
图7 复发和NRM死亡累积发生率的竞争风险曲线
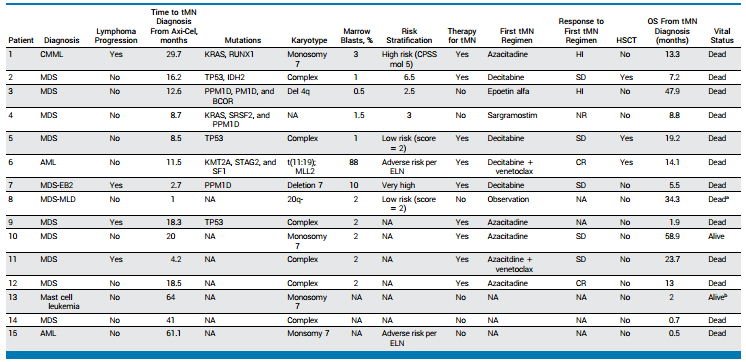
275例患者中的24例 (9%) 在接受Axi-cel 治疗后被诊断为继发恶性肿瘤(SMN,不包括非黑色素瘤皮肤癌)。从Axi-cel回输至治疗相关骨髓增生异常综合征(tMN)诊断的中位时间为16.2个月(IQR,8.5个月-29.7个月)。在15例tMN患者中,4例患者在确诊tMN时伴有淋巴瘤进展(表3)。
表3 接受Axi-cel治疗后的tMN
淋巴瘤未复发的患者的免疫重建及迟发性感染情况
评估Axi-cel回输后6个月至24个月期间淋巴瘤未复发的患者的免疫重建及迟发性感染情况(图8)。在该时段内,31.2%(34/109)的患者发生了感染,其中17%(18/109)的患者经历了严重感染。
在Axi-cel回输后12至24个月间,23.6%(21/89)的患者发生了感染,其中10%(9/89)为严重感染。大多数感染事件为呼吸道感染(非COVID-19,后者较为罕见),其中肺炎为最常见的临床综合征。在有详细数据记录的严重感染事件中,5例在感染初期报告的绝对中性粒细胞计数低于1.000/μL,而在12例中有6例报告的IgG水平低于400mg/dL。

图8 接受Axi-cel治疗后6个月至2年间发生的感染事件
在CAR-T细胞治疗后,血细胞减少症是一个常见的并发症,且中性粒细胞减少症的出现通常伴有血小板减少症和贫血。在治疗后1年和2年时,持续性≥3级中性粒细胞减少症(绝对中性粒细胞计数<1.000/mL)的发生率分别为9.2%和10%,持续性≥2级血小板减少症(血小板计数<75k/μL)的发生率分别为9.2%(10/109)和3.6%(3/84),持续性2级贫血(血红蛋白<10g/dL)的发生率分别为9.2%(10/109)和6.0%(5/84)。与治疗前相比,随着治疗时间延长,中性粒细胞计数有所下降,血红蛋白水平上升,而血小板计数大体保持稳定(图9)。

图9 在基线、12个月和24个月时,接受Axi-cel治疗的患者的免疫参数
研究结论
真实世界研究中,Axi-cel治疗R/R LBCL的长期疗效与关键注册临床试验ZUMA-1的报告结果一致,均在5年随访时观察到持续和持久的反应。中位随访58个月时,29%的R/R LBCL患者仍存活且维持疾病缓解状态,提示Axi-cel治疗后获得PR或CR的R/R LBCL患者具有治愈潜力,有可能实现长时间的无病生存。然而,后期感染和SMN的发生是降低CAR-T细胞疗法长期存活率的关键问题,尤其是对老年人而言;针对这一特定患者群体,需制定长期淋巴瘤复发预防策略、感染风险控制措施以及癌症筛查方案。
免责声明:本资料为专业医学资料,旨在促进医药信息的沟通和交流,仅供医疗卫生专业人士参考;任何处方请参考产品最新详细处方资料。本文件可能包含涉及医学情况、健康及治疗方法的信息。相关信息不得用作诊断或治疗,不能替代专业医学意见。
审批编号:NP-NHL-Axi-Cel-2024.8-23 valid until 2026.8
供稿与审核:临床开发与医学部
推荐阅读
【2024 EHA】通过早期预防性干预处理,CAR-T细胞疗法有望实现门诊给药
【2024 EHA】在CAR-T细胞时代,接受三线治疗的R/R DLBCL患者的预后显著改善
【2024 EHA】免疫组化检测的CD19阴性对接受Axi-cel治疗的淋巴瘤患者的结局影响
【2024 EHA】欧美真实世界中Axi-cel治疗DLBCL和FL的安全性结局:系统综述和荟萃分析
【2024 EHA】真实世界中,Axi-cel治疗R/R LBCL患者的制备经验:2L vs. 3L+
【2024 EHA】Axi-cel治疗复发或难治性原发性纵隔大B细胞淋巴瘤患者的疗效卓越:一项来自法国的登记研究
【2024 EHA】预防性使用地塞米松可降低Axi-cel治疗NHL后的3-4级ICANS发生率
【2024 EHA】ALYCANTE Ⅱ期研究:Axi-cel回输后第14天的早期PET评估可预测LBCL患者的结局
【2024 ASCO】ZUMA-3研究:R/R B-ALL患者接受Brexu-cel治疗后的长期生存结局
关于复星凯特
复星凯特生物科技有限公司为复星医药与美国Kite Pharma(吉利德科学旗下公司)的合营企业,深耕肿瘤免疫细胞治疗领域,于2021年6月获批上市国内首个CAR-T细胞治疗产品—奕凯达®(阿基仑赛注射液),目前产品已惠及超700位复发/难治性大B细胞淋巴瘤患者。未来,复星凯特将积极扩展更多适应症、发展新靶点新技术并加速实体瘤领域研发进程,引领中国细胞治疗产业发展。
有关复星凯特更多信息,请访问www.fosunkitebio.com






































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论