

试验药物简介
TQH2722(BSI-045A) 是一种靶向 IL-4Rα 的人源化单克隆抗体,由正大天晴与博奥信生物共同开发。该药可导致白细胞介素-4(IL-4) 和白细胞介素-13(IL-13) 信号的双重阻断,从而抑制 2 型炎症通路,最终达到治疗特应性皮炎、哮喘、慢性鼻窦炎等 2 型炎症性疾病的目的。
主要入选标准
(1)年龄18-75周岁(含),性别不限;
(2)符合特应性皮炎诊断,患病时间至少1年;
(3)筛选和随机时,EASI≥16分、IGA≥3分、BSA≥10%;
(4)筛选前6个月内,曾接受过至少4周中强效或至少2周超强效外用糖皮质激素(TCS)治疗或足量足疗程的全身糖皮质激素治疗,疗效不充分者;或受试者因不良反应或潜在风险,不能接受以上治疗者。
主要排除标准
(1)随机前12周或5个半衰期(以时间较长者为准)接受过抗IL-4R单克隆抗体、抗IgE单克隆抗体或其它生物制剂;
(2)存在可能干扰研究评估的皮肤合并症,包括但不限于疥疮、原发性皮肤淀粉样变、皮肤T细胞淋巴瘤、银屑病等;
(3)随机前12周内接种过减毒活疫苗或计划在研究期间接种;
(4)受试者可能存在活动性的结核分枝杆菌感染;
(5)既往有特应性角结膜炎病史且累及角膜。
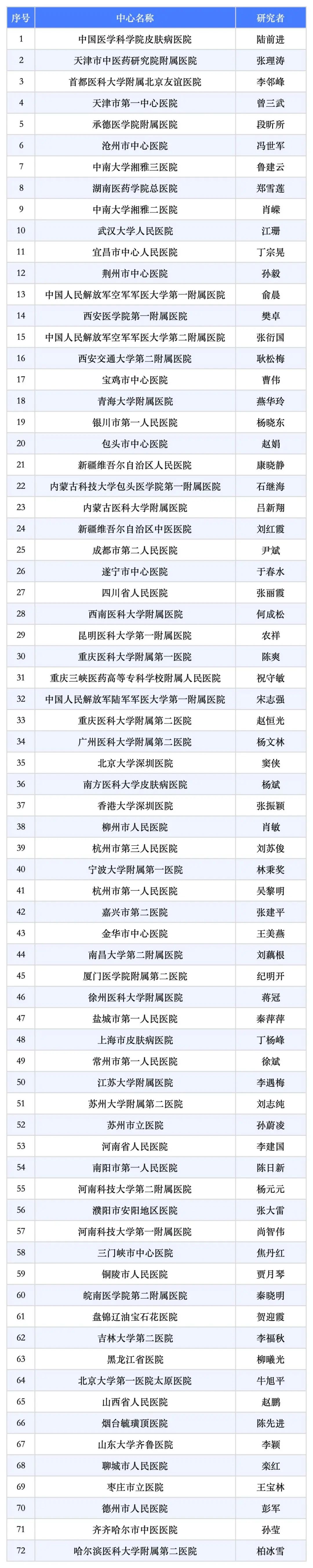
研究中心信息
如果符合以上条件或有意向参加该项研究,可扫描下方二维码报名

博奥信是一家处于临床阶段的全球化创新生物技术公司,致力于应用其专有的抗体技术平台开发创新疗法,使患者在免疫及肿瘤疾病的治疗中获益。成立于2017年,博奥信通过内部专有的H³(高通量,高含量,高效率)抗体发现平台、SynTracer® 高通量抗体内吞筛选平台、Flexibody®双功能抗体技术平台及全球合作建立了一系列创新药物管线。目前共有7项自研产品在中美开进入临床试验阶段,其中Bosakitug(BSI-045B/TQC2731,抗TSLP单抗)正在中美开展针对严重哮喘、慢性鼻窦炎伴鼻息肉和特应性皮炎的临床II期试验。更多公司及管线信息,请访问www.biosion.com。





































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论