
鼻咽癌(NPC)是起源于鼻咽黏膜内层的上皮性恶性肿瘤,常发生于东亚和东南亚。由于症状不典型,超过70%的NPC患者在初诊时已被诊断为局部区域晚期,5年整体生存率(OS)约70%,显著低于早期患者的92~98%。目前,诱导化疗后联合同期放化疗是局部晚期鼻咽癌(LA-NPC)的标准治疗方案,铂类化疗是诱导化疗阶段的基石。然而对于铂类化疗后疾病进展的NPC,目前尚无可靠的标准治疗方案。近日,深圳市人民医院肿瘤放疗科吴事海、朴莹、杨垚三位医生报道了一例LA-NPC患者,在铂类化疗不敏感的情况下,通过联合特瑞普利单抗和西妥昔单抗与放射治疗,在放疗结束后2个月达到了临床完全缓解,且未出现严重的治疗相关不良事件。该病例发表在《肿瘤前沿》(Frontiers in Oncology)期刊上1,为LA-NPC的治疗提供了新思路。
性别:女性
年龄:55岁
既往史:无重大疾病史
现病史:2022年7月,患者因持续5个月的颈部肿块增大伴疼痛入院
体格检查和辅助检查:
疾病诊断:
鼻咽非角化性未分化型细胞癌,IVa期(T3N3M0)(依据AJCC第8版TNM分期系统)
【影像学资料】

治疗前的鼻咽和淋巴结MRI(2022年7月)
GP诱导化疗治疗
2022年7月-8月:患者接受了两个周期的GP化疗方案(吉西他滨1000mg/m2,D1、8;顺铂75mg/m2,D1;每21天一个周期)。化疗后出现吞咽困难症状。
随后的MRI显示鼻咽部病灶缩小,但颈部淋巴结增大。此外,化疗期间发生了显著的不良事件,包括3级贫血、1级白细胞减少、1级血小板减少和2级肾功能不全。
【影像学资料】
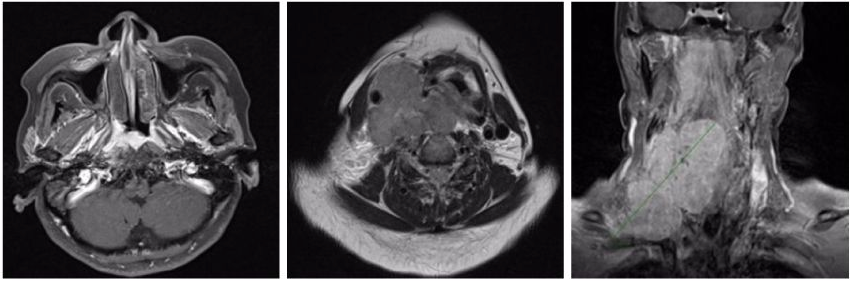
两个周期GP化疗后的鼻咽和淋巴结MRI(2022年8月)
【治疗过程中的病理检查】
为了进一步明确颈部淋巴结增大的性质,进行了细针穿刺活检,结果显示:
病理分析证实为鼻咽癌淋巴结转移
免疫组化显示表皮生长因子受体(EGFR)表达强度为90%,评分为3+;程序性死亡配体1(PD-L1)结合阳性评分(CPS)为50。
化疗不耐受后接受特瑞普利单抗和西妥昔单抗联合放疗
2022年8月19日:考虑到患者对化疗不耐受,患者开始接受特瑞普利单抗(240mg,Q3W)和西妥昔单抗(初始剂量400mg/m2,随后每周250mg/m2)联合容积弧形调强放射治疗(VMAT)。第一周仅接受特瑞普利单抗联合西妥昔单抗负荷剂量治疗,患者颈部肿胀和吞咽困难症状明显改善。随后CT扫描显示肿瘤略有缩小。
【影像学资料】
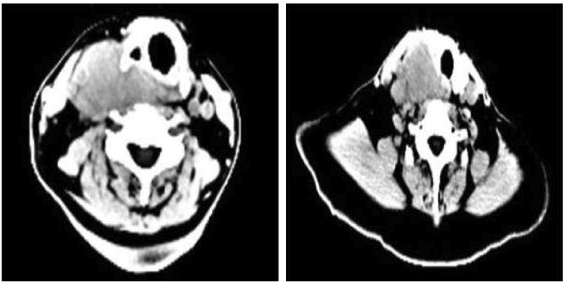
特瑞普利单抗和西妥昔单抗负荷剂量治疗后的淋巴结CT(2022年8月)
2022年8月25日- 10月8日:开始进行VMAT,治疗剂量分布为:69.96Gy/33F至肿瘤,66Gy/33F至颈部淋巴结,60Gy/33F至规划靶区1,50.1Gy/33F至规划靶区2,每周5次。同时继续特瑞普利单抗和西妥昔单抗静脉注射治疗。由于颈部淋巴结迅速缩小,每两周调整一次放疗计划。整个放疗期间,患者发生了1级恶心和2级口腔黏膜炎。
治疗后MRI显示患者肿瘤部分缓解(PR)。
【影像学资料】
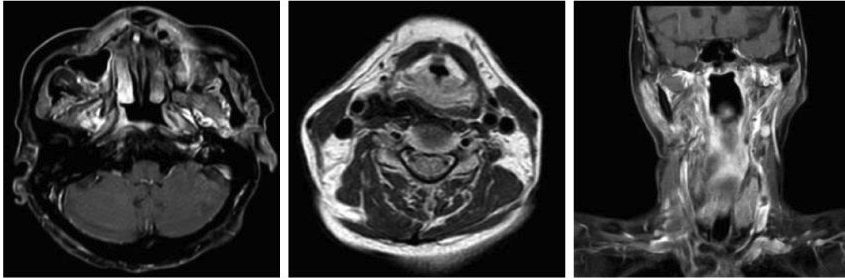
放疗后的鼻咽和淋巴结MRI(2022年10月)
2022年10月:放疗结束后,患者继续接受特瑞普利单抗(240mg,Q3W)和西妥昔单抗(250mg/m2,QW)治疗,直至2个月后MRI检查显示完全缓解(CR)。
患者此后定期随访影像学检查,直至该病例报告撰写时(2024年2月),患者未再接受其他治疗,且无病生存。
【影像学资料】
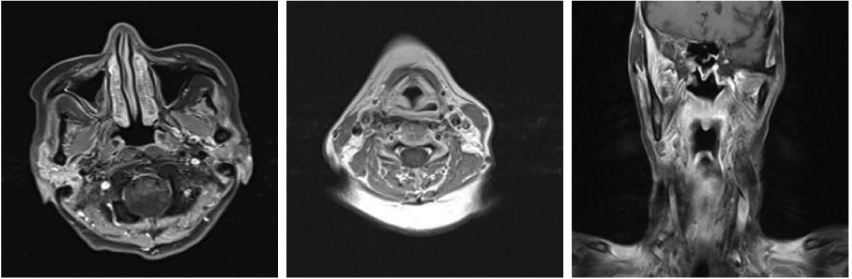
放疗结束2个月后的鼻咽和淋巴结MRI(2022年12月)

对于LA-NPC的治疗近年来取得了一些进展,但该疾病的治疗和管理仍然面临重大挑战。目前,针对诱导化疗不敏感的LA-NPC患者的研究较少,特别是对在接受铂类诱导化疗后出现疾病稳定或进展的患者。本例中,患者在接受特瑞普利单抗和西妥昔单抗的负荷剂量治疗后,症状显著改善。
以特瑞普利单抗为代表的免疫检查点抑制剂(ICIs)在复发或转移性NPC患者中的抗肿瘤疗效和安全性已得到充分验证,成为治疗新标准。特瑞普利单抗更是走出国门、获得国际认可,成为美国首个且唯一获批用于鼻咽癌治疗的药物。而对于LA-NPC,免疫治疗也正在重塑该类患者的治疗格局。
理论上,放疗可以通过改变肽组成和增强主要组织相容性复合体I类蛋白的表达来改变肿瘤微环境,并激活DNA双链断裂修复途径,提高癌细胞中PD-L1的表达。这为放疗与抗PD-1治疗的联合应用提供了有力的理论基础。西妥昔单抗联合放/化疗已被证实可有效治疗NPC患者,其通过抑制EGFR信号传导和激活自然杀伤细胞介导的抗体依赖性细胞毒作用发挥抗癌作用。另一方面,这种免疫刺激活性也可能导致免疫抑制反馈回路,包括癌细胞上调PD-L1表达和募集免疫抑制性调节T细胞和髓源性抑制细胞,而ICIs可以克服这些免疫抑制性反机制,因此西妥昔单抗联合ICIs治疗具有一定的理论基础。
此病例首次展示了特瑞普利单抗联合西妥昔单抗及放疗在铂类化疗不敏感的LA-NPC中的应用,显示出显著的临床获益和良好的安全性,为探索该类患者的个体化治疗策略提供了重要参考,期待进一步开展前瞻性随机对照临床试验以验证其广泛适用性和安全性。
参考文献:
PIAO Y, YANG Y, WU S, et al. Toripalimab plus cetuximab combined with radiotherapy in a locally advanced platinum-based chemotherapy-insensitive nasopharyngeal carcinoma patient: a case report [J]. Front Oncol, 2024, 14: 1383250.


声明
 点击“阅读原文”, 查阅原文
点击“阅读原文”, 查阅原文




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论