


迪哲医药
向美国FDA递交舒沃哲®新药上市申请
11月8日,迪哲医药宣布公司已于近日向美国食品药品监督管理局(FDA)递交舒沃哲®(通用名:舒沃替尼片)的新药上市申请(New Drug Application,NDA),用于既往经含铂化疗治疗时或治疗后出现疾病进展,并且经FDA批准的试剂盒检测确认,存在表皮生长因子受体(EGFR)20号外显子插入突变(exon20ins)的局部晚期或转移性非小细胞肺癌(NSCLC)的成人患者。
舒沃哲®是迪哲医药自主研发的新型肺癌靶向药,也是首款向美国FDA递交新药上市申请的中国源创肺癌靶向药,于去年8月通过优先审评在中国获批上市,已成为EGFR exon20ins NSCLC二/后线唯一标准治疗方案。凭借优异的疗效和安全性数据,舒沃哲®此前已获FDA授予全线治疗EGFR exon20ins NSCLC的“突破性疗法认定”(Breakthrough Therapy Designation,BTD),可享有包括FDA专家全程密切指导与支持等一系列加快药物开发的政策,加速推进药物上市进程。

燃石医药
与迪哲医药同步开发伴随诊断试剂获NMPA批准
近日,燃石医学与迪哲医药联合宣布,双方合作开发的舒沃哲®(通用名:舒沃替尼片)EGFR 20号外显子插入突变(exon20ins)的伴随诊断试剂获得了中国国家药品监督管理局(NMPA)的批准,成为中国伴随诊断试剂指导原则出台后NMPA批准的首个肺癌领域基于NGS技术平台同步开发的伴随诊断试剂盒。
该伴随诊断的获批是基于燃石医学自主研发的朗克®CDx(人类9基因突变联合检测试剂盒)与迪哲医药的创新EGFR exon20ins靶向药-舒沃哲®的关键临床研究同步开发完成,为EGFR exon20ins非小细胞肺癌患者提供了创新精准诊疗方案。

博睿康
上海首例脑机接口产品
临床试验植入手术顺利完成
近日,博睿康医疗科技(上海)有限公司与清华大学生物医学工程学院洪波教授团队合作开发的脑机接口产品NEO在华山医院顺利完成全国第三例、上海第一例临床试验植入手术。该产品在上海完成研发和型式检验,于2024年8月成为我国首款进入创新医疗器械特别审查程序的脑机接口产品,为脑机接口产业化铺平了道路。

此次植入手术是博睿康产品进入创新特别审查程序后的首例人体植入手术,并联合华山医院首次采用了自主研发的“在线时域空域脑功能定位系统”等创新技术,无需术中唤醒患者,即可快速精准定位手部运动/感觉脑区,实现精准功能定位植入。

英矽智能
成功发现FIC潜力的先导化合物,
与赛诺菲研发合作达到里程碑
近日,英矽智能宣布继2022年11月签署合作协议后,在与赛诺菲的多年研究合作中取得重要进展。双方在针对难成药转录因子靶点的项目开发中,发现了具有“全球首创”(first-in-class, FIC)潜力的先导化合物。该候选分子是在英矽智能自研AI平台Pharma.AI赋能下辅助发现的,有望用于肿瘤领域疾病治疗。

在这项合作中,双方首先依托英矽智能自有生成生物学AI平台PandaOmics,组建联合研发团队专注于业界认为“难成药”的高度创新靶点;再通过高自由度的生成式AI药物设计引擎Chemistry42获得创新分子骨架,并在此基础上开展进一步优化,破解难成药挑战。

科笛集团
全球首个且唯一外用4%米诺环素中国获批,
痤疮患者有新药可用!
11月11日,中国国家药品监督管理局(NMPA)官网公示,科笛集团申报的盐酸米诺环素泡沫剂已在中国获批上市。这是科笛集团引进的一款外用4%米诺环素泡沫剂(CU-10201)。根据中国国家药监局药品审评中心(CDE)优先审评公示,该药本次获批用于9岁及以上儿童和成人患者的非结节性中度至重度寻常痤疮炎症性病变的局部治疗。


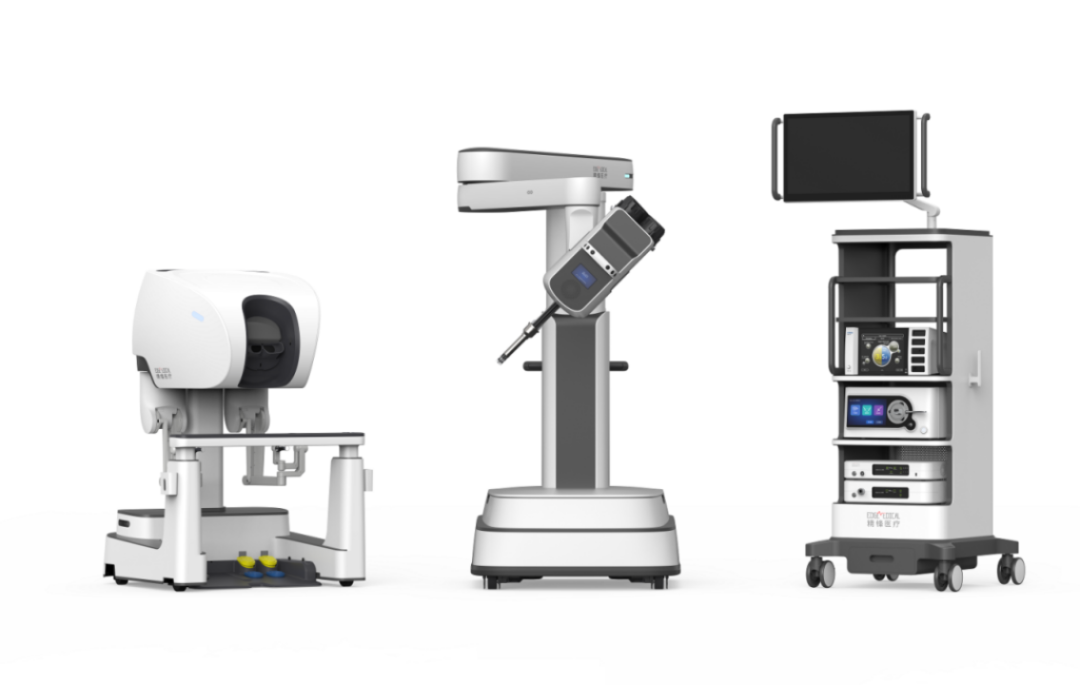
精锋医疗
国内首个,国际第二个!
精锋®单孔腔镜手术机器人多科室临床应用获批上市
10月31日,精锋®单孔腔镜手术机器人获得国家药品监督管理局(NMPA)批准,其应用范围拓展至妇科、泌尿外科、胃肠外科和肝胆外科手术。这是精锋®单孔腔镜手术机器人继2023年11月,获批应用于妇科领域之后再度拓展新科室注册证,并成为国内首个、国际第二个获批在多科室应用的单孔腔镜手术机器人。

芳拓生物
自主研发nAMD基因治疗产品II期临床试验获美国FDA许可
11月11日,芳拓生物宣布其自主研发的用于治疗新生血管性年龄相关性黄斑变性(nAMD)的重组腺相关病毒(rAAV)基因治疗产品(产品代号FT-003)获得美国食品药品监督管理局(FDA)II临床试验许可。
目前,nAMD患者需长期定期(每2-3个月)进行玻璃体腔内注射抗VEGF制剂。在真实世界中,绝大多数患者因频繁注射带来的不便,依从性很差,严重影响了抗VEGF治疗效果,导致患者长期视力预后不良,直至失明,并且伴随沉重的治疗负担。基因疗法能够将目的基因片段导入患者眼底视网膜细胞,使视网膜细胞成为一个生物工厂持续表达和分泌功能性蛋白,进而达到治疗疾病的目的。基因药物持续表达,一方面有实现一次给药、持续有效的潜力,另一方面可以维持功能性蛋白含量的稳定,避免浓度变化带来的疾病病理过程的加剧,AAV基因治疗有望成为nAMD的一线疗法,为患者提供更便利更持久的治疗方案。


血霁生物
全球新FIC细胞治疗产品获FDA儿科罕见病资格认定
10月18日,血霁生物宣布自主研发的“全球新”Fisrt-in-Class细胞治疗产品XJ-MK-002治疗先天性无巨核细胞性血小板减少症获得美国食品药品监督管理局(FDA)认证授予儿科罕见病资格认定(Rare Pediatric Disease Designation, RPDD)。本次儿科罕见病资格的认定将有机会为这个严重的、或危及生命的儿童血小板疾病的治疗提供新的选项。
血霁生物是全球第三家、中国第一家血小板再生的细胞治疗公司,致力于通过体外诱导干细胞定向产生血小板作为先导产品,实现无任何基因编辑的分化流程,获得安全性高、成熟度高、无致瘤风险的血小板,可以用于几乎全年龄段人群的血小板输注,对儿童用血也非常安全。同时,ABO配型的造血干细胞来源的血小板和无免疫原性的iPSC来源的通用型血小板,将覆盖各类不同的血小板用血诉求,带来“全球新”Fisrt-in-Class的、安全有效的、成本可控的、高可及性的血小板细胞治疗产品,实现中国乃至世界的第二次输血革命。

澎立生物
助力全球首创Usher综合征新药IND获美国FDA批准
近日,美国食品药品监督管理局(FDA)正式批准了瑞风生物针对Usher综合征的创新药物RM-101的IND申请。这一批准标志着Usher综合征全球首个基于AAV的基因编辑药物研发取得了里程碑式的突破与进展。
澎立生物为瑞风生物RM-101创新药物产品提供了临床前不同剂量药物长期表达效果研究及给药后视网膜功能和结构变化的研究评价服务。在genome-modified C57BL/6小鼠上开展了不同剂量RM-101经视网膜下腔注射或玻璃体腔注射后评价视网膜功能和结构的变化,终点采集视网膜组织后分析表达效果的差异,科学地论证了注射后眼内的表达效果以及给药对视网膜结构和功能的影响。

瑞吉生物
全球首款冻干带状疱疹mRNA疫苗临床试验申请获CDE批准
10月23日,由瑞吉生物自主研发的冻干带状疱疹mRNA疫苗的临床试验申请获得了中国国家药品监督管理局药品审评中心的默示许可。该疫苗为自主知识产权的全球首款冻干带状疱疹mRNA疫苗。


晶泰科技
与Janssen Biotech签署大分子药物发现AI平台授权协议
近日,晶泰科技宣布其下属部门Ailux Biologics与强生公司(Johnson & Johnson)下属杨森生物技术公司(Janssen Biotech, Inc.)签署大分子药物发现AI平台授权协议。
根据协议,晶泰科技商业授权Janssen Biotech及其附属公司使用Ailux Biologics自主开发的XtalFold™ AI平台进行大分子药物的发现和工程化设计。XtalFold™是一套基于AI的软件平台,能够为大分子药物研发提供快速且准确的结构信息,在多个研发阶段加速创新。

强联智创
中国原研原创AI新术式亮相2024WFITN
近日,2024年第十七届世界神经介入放射和治疗联合会于美国纽约举行。会议期间,首都医科大学宣武医院张鸿祺教授向来自全球的神经介入领域专家介绍了中国原研原创的AI辅助神经介入手术治疗技术——颅内动脉瘤手术智能化解决方案。
该方案由复旦大学附属华山医院顾宇翔教授团队和首都医科大学宣武医院张鸿祺教授团队联合强联智创®共同开发,是中国原创、全球首创的产品,开创AI辅助神经介入手术治疗的先河,填补国际空白。这是中国神经介入领域的AI技术第一次在国际级的学术盛会上亮相,引发了在场专家的热烈讨论。

同心医疗
慈孚®VAD多中心随访结果重磅登陆国际舞台
近日,第18届欧洲机械循环支持峰会(European Mechanical Circulatory Support Summit, EUMS)在德国汉诺威举行。EUMS是国际晚期心力衰竭领域极具影响力的科学大会,为晚期心力衰竭的创新疗法、临床实践标准设置及跨学科治疗策略讨论提供国际化平台。
大会上,首都医科大学附属北京安贞医院贡鸣教授携慈孚®VAD(型号:CH-VAD)多中心联合研究结果(Clinical Outcomes in Patients With a Novel Fully Magnetically Levitated Left Ventricular Assist Device: A multi-center study)亮相。慈孚®VAD是中国首个获批上市的全磁悬浮左心室辅助装置,具有完备的自主知识产权和多项关键突破性技术,凭借其创新的结构设计带来的卓越血液相容性和血流动力学表现,为晚期心力衰竭患者术后长期高质量生活提供了保障。

贡鸣教授在EUMS 2024大会现场作专题报告
本研究中,接受慈孚®VAD治疗的患者生存率高,并发症发生率低,术后心功能改善明显,术后长期生活质量显著提高。本研究结果展示了慈孚®VAD的卓越性能以及中国LVAD临床应用的优秀水平,获得了国际医学界的高度认可。

今是科技
深度合作研究成果入选第66届美国血液学会年会
近日,今是科技与陆道培集团合作的最新研究成果《High-Accurate Third-Generation Sequencing to Comprehensively Decipher BCR::ABL1 TKIs in-Cis Resistant Mutations》成功入选第66届美国血液学会年会,这一喜讯标志着双方在血液肿瘤精准医疗领域的深度合作取得了重要阶段性成果,并再次证明了中国科技创新在国际舞台上的竞争力和影响力。


经过十余年的深入研究与系统性的投资布局,红杉中国在医疗健康领域先后投资了超过200家具有鲜明技术特征和高成长性的医疗健康企业,投资范围覆盖创新药、医疗器械、医疗服务、精准医疗、数字医疗等多个细分领域,其中超过45家已经在A股、港股、美股完成IPO。

推荐阅读
壹
贰
叁
肆
伍




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论