
今年2月,Iovance Biotherapeutics公司的肿瘤浸润淋巴细胞(TIL)疗法Amtagvi(lifileucel)获得了美国食品药品监督管理局(FDA)的上市批准,用于治疗晚期黑色素瘤。值得一提的是,Amtagvi是全球首款获批上市的TIL细胞疗法,定价为51.5万美元(约等于人民币370万元)。在获批上市后不到一周的时间内,Iovance在其内部细胞治疗中心迅速启动了Amtagvi的商业生产。
另外,在全球布局方面,Iovance已于今年将Amtagvi提交至欧盟监管机构审核并获受理,预计2025年上半年在英国获得批准上市,2025年下半年在欧盟和2025年年中在加拿大获得批准上市。此外,公司还规划在2025年将该药物的商业化版图扩展至澳大利亚和其他黑色素瘤高发国家。随着新市场的开发,该药物有望每年惠及超过2万名已接受过其它疗法且疗效不佳的晚期黑色素瘤患者。
公司在财报中还称,自2024年4月首次商业化临床治疗以来,截止到2024年第三季度末,已有146名患者接受了Amtagvi™治疗。2024年全年的产品收入预计在1.6亿至1.65亿美元之间,反映了自2024年2月中旬美国食品药品监督管理局(FDA)批准上市后三个季度的Amtagvi™销售额。

Iovance总裁兼临时首席执行官Frederick Vogt博士指出,随着授权治疗中心网络的扩大及产品的推广,Amtagvi™的需求不断增长,推动了更多的患者转诊采用。预计需求趋势将在今年接下来的两个月和未来几年内加速增长。
除了黑色素瘤,Iovance还在探索该产品在其他类癌症中的临床应用,如非小细胞肺癌(NSCLC)和子宫内膜癌。在NSCLC方面,IOV-LUN-202注册性Ⅱ期试验的入组正在加速,并且公司期待在2025年的医学会议上展示更新的数据。对于子宫内膜癌,IOV-END-201的Ⅱ期试验已经开始招募患者。
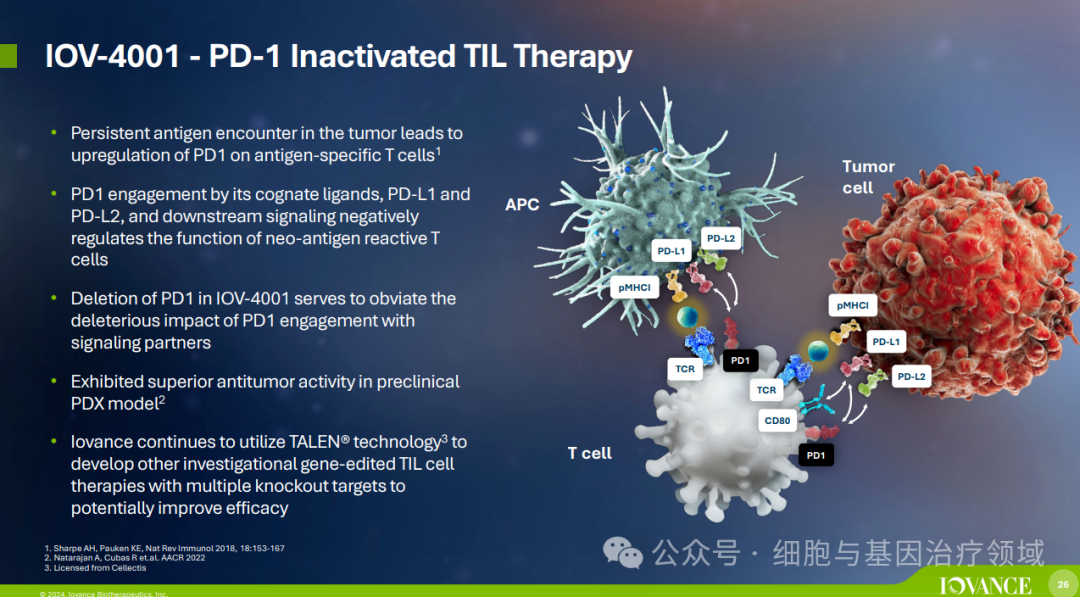
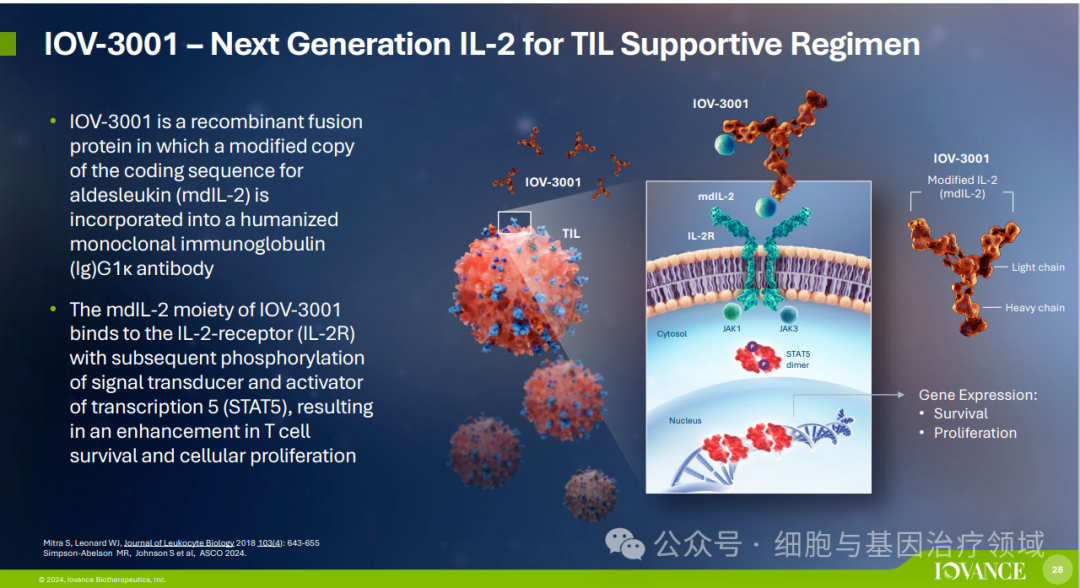
此外,Iovance还在开发下一代TIL细胞疗法产品,包括PD-1基因被敲除的TIL细胞疗法(IOV-4001)、结合下一代IL-2(类似物)的TIL治疗方案(IOV-3001)和下一代细胞因子偶联TIL细胞疗法(IOV-5001)。这些努力旨在进一步提高TIL疗法的安全性和疗效,满足更多癌症患者的需求。


据悉,目前Iovance拥有的现金、现金等价物等总额为4.038亿美元,公司预计目前的现金状况和预期的产品收入足以支持公司当前和后续的运营计划。
E.N.D

往期文章推荐:
图解NK细胞疗法收购价约1.87亿元,东北制药将正式收购国内一细胞治疗企业70%股权
世界首创!邦耀生物治疗红斑狼疮非病毒定点整合PD1-CAR-T疗法国内获批临床
上海发布三年行动方案,持续支持细胞与基因治疗、核酸药物、脑机接口等前沿领域创新研发(附政策解读)
广州发布新政,重点推进抗体药、疫苗、细胞与基因治疗、重组蛋白与多肽等产业化进程
石药集团首款基于mRNA-LNP的CAR-T细胞疗法(SYS6020)再获新适应症临床试验批准
全国约1/6细胞与基因治疗药物临床试验项目落地张江,创新成果“井喷”




































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论