
新药的获批将给患者带来新的希望,据美国FDA提供的公布结果,我们整理了2022年10月份FDA批准上市的药品。FDA在2022年10月份共陆续批准了6款新药和58款仿制药,此前三季度,FDA已批准了105款新药,包括15个BLA申请,和90个NDA申请,距2022年结束还剩2个月,预计获批的新药数量将突破120个,创下历史新高。
其中在10月份FDA批准上市的6款新药中,包含2个新生物制品申请(BLA)和4个新药申请(NDA)。
一、新药申请(NDA)
10月份FDA批准上市的4款新药包括:
- Teva公司的Alvaiz,用于治疗免疫性血小板减少症(ITP)和再生障碍性贫血;
- Nevakar Injectables公司的Norepinephrine Bitartrate in 0.9% Sodium Chloride,用于治疗有严重急性低血压的成人患者;
- Scpharmaceuticals公司的Furoscix,用于治疗纽约心脏协会II/III级慢性心力衰竭成人因液体超负荷而引起的充血;
- Hikma公司的Cefazolin Sodium,用于治疗呼吸道感染、尿路感染等敏感菌所致的感染。
表1 2022年10月FDA批准上市的改良型新药

- ALVAIZ
据药融云数据库查询显示,本次FDA共批准了Teva公司申请的Alvaiz片剂四种规格,分别是9mg、18mg、36mg和54mg,用于治疗免疫性血小板减少症(ITP)和再生障碍性贫血。
Alvaiz美国批文信息
截图来源:药融云美国FDA批准药品数据库

图1 Alvaiz批准信
- NOREPINEPHRINE BITARTRATE IN 0.9% SODIUM CHLORIDE
FDA批准了Nevakar Injectables申请的Norepinephrine Bitartrate in 0.9% Sodium Chloride静脉注射剂的3种规格,分别是EQ 4mg base/250 ml (EQ 16mcg base/ml)、EQ 8mg base/250ml (EQ 32mcg base/ml)和EQ 16mg base/250ml (EQ 64mcg base/ml)。NDA规定了在0.9%氯化钠注射中使用去甲肾上腺素可以用来治疗有严重急性低血压的成人患者。

图2 Norepinephrine Bitartrate in 0.9% Sodium Chloride批准信
- FUROSCIX
FDA批准了Scpharmaceuticals公司申请的Furoscix皮下注射液,这是一种通过体内输液器输送的呋塞米专利制剂,用于治疗纽约心脏协会II/III级慢性心力衰竭成人因液体超负荷而引起的充血。Furoscix不适用于紧急情况或急性肺水肿患者。体内输注器将仅提供80mg剂量的Furoscix。Furoscix禁用于无尿患者,对呋塞米或医用粘合剂有过敏史的患者禁用,同时禁用于肝硬化或有腹水患者。

图3 Furoscix批准信
- CEFAZOLIN SODIUM
FDA批准了Hikma申请的Cefazolin Sodium注射粉针的两种规格,分别是EQ 2gm base/vial和EQ 3gm base/vial。注射用头孢唑林是一种头孢菌素类抗菌药,适用于以下症状:呼吸道感染、尿路感染、皮肤和皮肤结构感染、胆道感染、骨骼和关节感染、生殖道感染、败血症以及心内膜炎。为了减少耐药菌的产生,保持注射用头孢唑啉和其他抗菌药物的有效性,注射用头孢唑啉只能用于治疗或预防已证实或强烈怀疑是由细菌引起的感染。

图4 Cefazolin Sodium批准信
二、生物制品申请(BLA)
10月份FDA批准上市的2款生物制品包括:
- 阿斯利康公司的Imjudo,联合Durvalumab用于治疗治疗患有不可切除的肝细胞性肝癌(uHCC)的成年患者;
- 强生公司的Tecvayli,用于治疗复发/难治性多发性骨髓瘤。
表2 2022年10月FDA批准上市的生物制品

- IMJUDO
Imjudo是一种细胞毒性T淋巴细胞相关抗原4(CTLA-4)阻断抗体,Durvalumab是一种人源化的PD-L1单克隆抗体,能够阻断PD-L1与PD-1和CD80的结合,从而阻断肿瘤免疫逃逸并解除对免疫反应的抑制。Imjudo和Durvalumab联合方案也被称之为Stride方案,该药曾获FDA授予的优先审评资格,用于治疗患有不可切除的肝细胞性肝癌(uHCC)的成年患者。
Imjudo获特殊审批情况
截图来源:药融云全球药物研发数据库
服用Imjudo最常见的不良反应是皮疹、腹泻、疲劳、瘙痒、肌肉骨骼疼痛和腹痛。患者最常见的实验室异常是AST升高、ALT升高、血红蛋白降低、钠降低、胆红素升高、碱性磷酸酶升高和淋巴细胞降低。

图5 Imjudo批准信
- TECVAYLI
Tecvayli是强生公司开发的一款BCMA/CD3双抗,用于治疗复发/难治性多发性骨髓瘤。这是首款获批治疗多发性骨髓瘤的双特异性疗法,也是首款获批靶向BCMA的双特异性抗体。据药融云数据库显示,该药早前已于今年8月24日在欧盟提前获批上市,用于治疗多发性骨髓瘤。
Tecvayli药物基本信息(部分,微信搜索"药融云小程序"进行相关更多数据查询)
截图来源:药融云全球药物研发数据库
在安全性方面,Teclistamab-CQYV带有威胁生命或致命的细胞因子释放综合征(CRS)和神经毒性(包括免疫效应细胞相关的神经毒性)的黑框警告。报告的最常见不良反应是发热、CRS、肌肉骨骼疼痛、注射部位反应、疲劳、上呼吸道感染、恶心、头痛、肺炎、腹泻和实验室异常。

图6 Tecvayli批准信
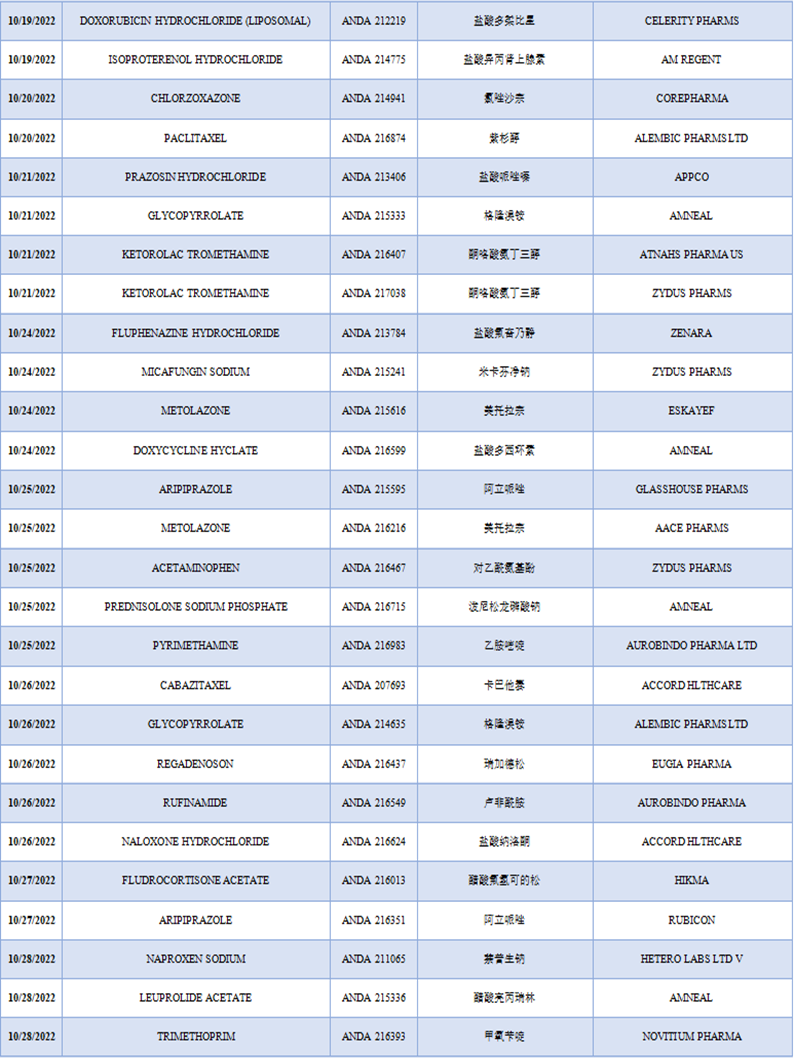
三、仿制药申请
10月份FDA批准上市了58款仿制药,相较于9月份有69款仿制药被FDA批准有所下降。10月份被批准仿制药数量最多的两个公司分别是:
- Zydus制药公司,有4款仿制药在10月份被批准,分别是Brivaracetam、Ketorolac Tromethamine、Micafungin Sodium和Acetaminophen。
- Amneal制药公司,有4款仿制药在10月份被批准,分别是Glycopyrrolate、Doxycycline Hyclate、Prednisolone Sodium Phosphate和Leuprolide Acetate。
具体数据如下表:
表3 2022年10月FDA批准上市的仿制药

参考资料:
[1]FDA官网:https://www.fda.gov/
[2]Alvaiz批准文件:Alvaiz (eltrombopag tablets) (fda.gov)
[3]Norepinephrine Bitartrate in 0.9% Sodium Chloride批准文件:Norepinephrine in Sodium Chloride (fda.gov)
[4]Furoscix批准文件:label (fda.gov)
[5]Cefazolin Sodium批准文件:https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/216109s000lbl
[6]Imjudo批准文件:https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/761289s001lbl.
[7]Tecvayli批准文件:https://www.accessdata.fda.gov/drugsatfda_docs/label/2022/761291s000lbl.
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论