
2024年6月28日,Iovance Biotherapeutics向欧洲药品管理局(EMA)递交了TIL细胞疗法lifileucel的上市许可申请(MAA),用于治疗曾接受过PD-1阻断抗体治疗的不可切除或转移性黑色素瘤成人患者(如果BRAF V600基因突变阳性,接受过 BRAF抑制剂±MEK抑制剂治疗)。如果获得批准,lifileucel将成为欧盟(EU)所有成员国中首个也是唯一一个获准用于此类疾病的疗法。
这次提交是继在2月美国获得FDA批准之后,lifileucel向全球监管机构递交申请的第一步。Iovance公司计划在2024年下半年向加拿大和英国提交lifileucel的上市申请,并在2025年向澳大利亚提交申请。

lifileucel此次MAA基于C-144-01临床试验的积极临床数据的支持。C-144-01是一项开放标签、多队列、多中心的2期临床试验,目的为检视单次注射lifileucel在接受PD-1/PD-L1抑制剂治疗期间或之后出现疾病进展的晚期黑色素瘤患者身上的疗效与安全性。
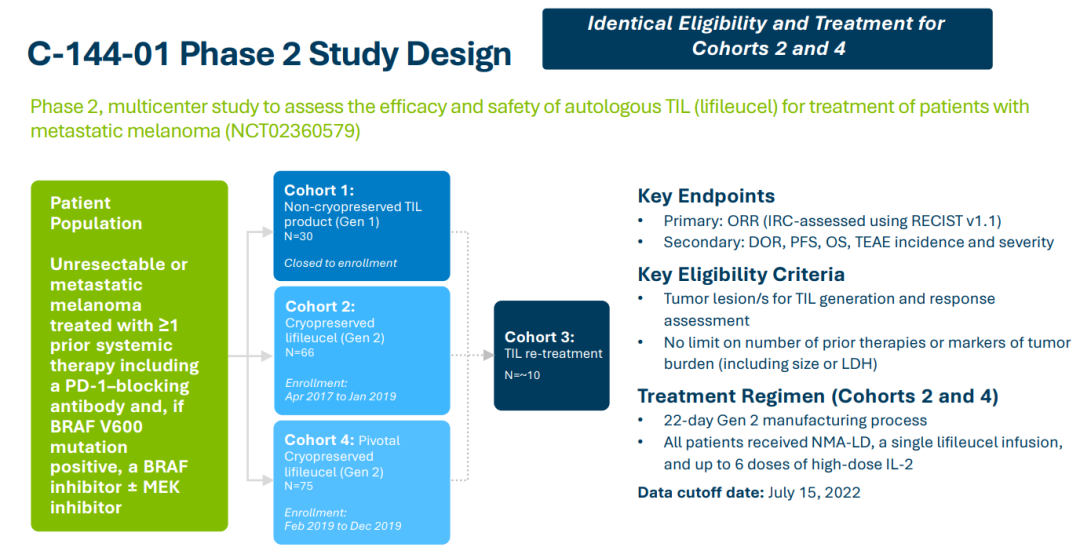
根据之前公布的试验结果,lifileucel展现持久的临床益处,中位随访时间为27.6个月时,在经过大量预治疗的患者中,独立审评委员会(IRC)评估的客观缓解率(ORR)为31.4%(95% CI:23.5-47.6),其中包含8位患者达完全缓解(CR)与40位患者达部分缓解(PR)。

此外,其临床试验安全性数据如下:

除黑色素瘤外,该疗法用于晚期非小细胞肺癌、宫颈癌、头颈部鳞状细胞癌、非小细胞肺癌的多个临床试验正在进行中。

监管战略与转化医学执行副总裁、医学博士Raj K. Puri表示:“此次提交的欧盟监管申请是将lifileucel推广到全球晚期黑色素瘤高发市场的第一步。未满足的需求和临床数据的优势将支持lifileucel作为欧盟首个也是唯一获批的疗法,用于治疗接受标准疗法后病情进展的晚期黑色素瘤患者。在美国获得加速批准后,我们的全球扩张战略将使可能接受lifileucel治疗的有重大未满足需求的患者人数增加一倍以上。”
总结
目前,多家新锐公司在致力于进一步改进TIL疗法,多款疗法已经进入临床开发阶段,国内布局TIL疗法的公司有沙砾生物、君赛生物、原启生物、卡替医疗、循生生物、天科雅生物、厚无生物、青岛华赛伯曼、莱芒生物及西比曼生物等,其中砂砾生物进展最快,公司开发的GT101针对多种实体瘤,已进入临床Ⅱ期阶段。
参考资料:
[1]Chesney J, Lewis KD, Kluger H, et al Efficacy and safety of lifileucel, a one-time autologous tumor-infiltrating lymphocyte (TIL) cell therapy, in patients with advanced melanoma after progression on immune checkpoint inhibitors and targeted therapies: pooled analysis of consecutive cohorts of the C-144-01 study. Journal for ImmunoTherapy of Cancer 2022;10:e005755. doi: 10.1136/jitc-2022-005755.
[2]公司官网
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


































![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)















 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论