

近日,NS Pharma宣布其杜氏肌营养不良症候选药物viltolarsen(商品名:Viltepso)III期临床试验失败。
杜氏肌营养不良症(DMD)是一种致命的罕见X连锁退行性神经肌肉疾病。全球范围内,大约每3500~5000名男性新生儿中就有1名DMD患儿。它由体内编码抗肌萎缩蛋白的基因变异引起,通常会引发呼吸和/或心脏衰竭,使得患者的预期寿命很少超过40岁。
Viltepso是一种反义寡核苷酸,通过跳过第53号外显子发挥作用。它于2020年3月在日本获批用于治疗确诊发生53外显子跳跃基因突变的DMD患者。2020年8月,Viltepso获得美国FDA加速批准上市,成为第2款用于治疗外显子53跳跃DMD的反义寡核苷酸(ASO)疗法。而第一款是2019年12月获得FDA批准的Sarepta公司药物Golodirsen(商品名:Vyondys 53®)。
这2款药物均为ASO疗法,属于小核酸疗法的一种,它们作用机制相同,通过屏蔽(跳跃)抗肌萎缩蛋白基因中的外显子53来促进功能性抗肌萎缩蛋白的产生。
Viltepso通过静脉输注给药,每周一次,剂量为80mg/kg。此次研究共招募77名DMD患者(可走动),主要评估Viltepso是否提高DMD患者的站立时间。经过48周治疗后,与安慰剂相比,接受Viltepso治疗的患者未出现统计学上的显著差异。
安全性方面,Viltepso的不良反应为轻度或中度,无患者因副作用而退出研究。
尽管未能通过 III 期研究,NS Pharma 总裁 Tsugio Tanaka 表示:“公司仍相信Viltepso可以为杜氏肌营养不良症患者带来益处。NS Pharma 将与 FDA 和其他监管机构合作,根据分析结果来确定如何开展接下来的工作。”
无独有偶,5月初,因为1例患儿死亡,辉瑞暂停了其DMD基因疗法fordadistrogene movaparvovec的3期临床试验。
近年来,杜氏肌营养不良,是小核酸药物研发的高产方向,目前已有4款ASO疗法获批。除了Viltepso,另外3款就是Sarepta Therapeutics开发的DMD小核酸疗法,分别是2016年获批上市的Eteplirsen、2019年获批上市的Golodirsen和2021年获批上市的Casimersen,均获得FDA加速审批。2023年,Eteplirsen销售额5.4亿美元,同比增长6%;Golodirsen 销售额1.3亿美元,同比增长11%;Casimersen 销售额2.74亿美元,同比增长28%。
关于NS Pharma
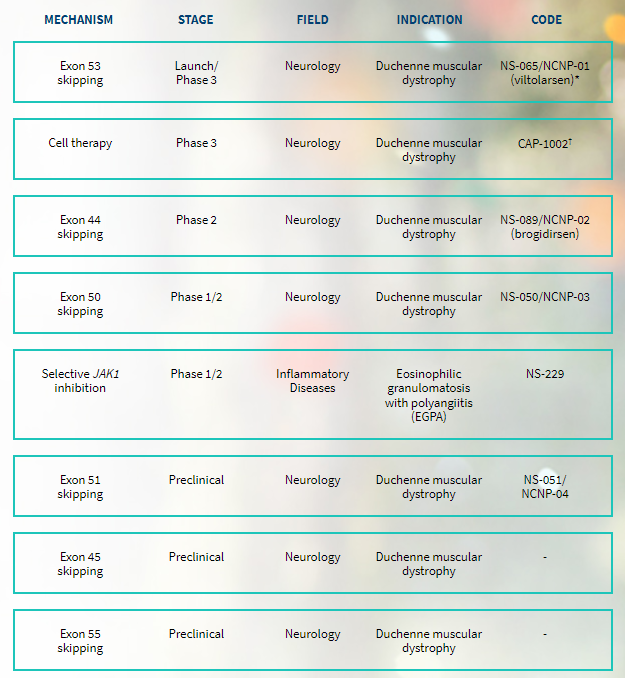
NS Pharma是日本新药株式会社Nippon Shinyaku的全资子公司,专注于研发治疗DMD药物。目前有8个管线,其中有7个用于治疗DMD。研发速度最快的是viltolarsen,已在日本获得批准上市,在美国已被有条件批准用于可跳过外显子53的DMD患者。
研发管线
参考资料:
https://www.biospace.com/article/ns-pharma-s-dmd-drug-viltespo-fails-confirmatory-phase-iii-trial/
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论