
2024年4月25日晚,华东医药发布2024年Q1业绩报告。公司实现营业收入104.11亿元,同比增长2.93%;实现归母净利润8.62亿元,同比增长14.18%;实现扣除非经常性损益的归母净利润8.38亿元,同比增长10.66%;营业收入及净利润环比2023年第四季度均实现正增长。(相关阅读:华东医药上半年营收超200亿!司美格鲁肽Ⅲ期临床已启动)
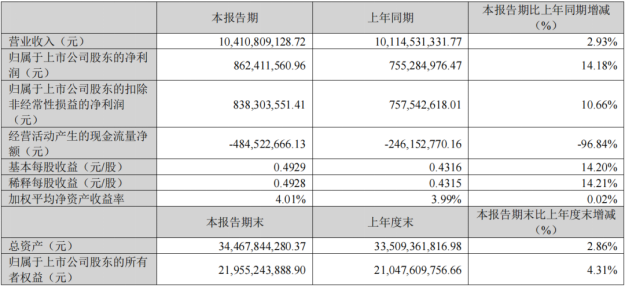
来源:公司财报
年入超400亿!肿瘤、自免、内分泌、医美等六大矩阵展现巨大潜力
此前,华东医药发布最新年报,2023年全年,其总营收406.24亿元,同比增长7.71%;净利润28.39亿元,增长13.59%;扣非归母净利润27.37亿元,增长13.55%。其中,医药工业实现销售收入122.17亿元,增长9.45%;净利润23.30亿元,增长9.63%。

华东医药差异化布局肿瘤、自身免疫、内分泌、医美、工业微生物以及医药商业,六大矩阵形成了全面均衡的能力,也使得公司在接下来行业的周期波动上有着其他药企无法轻易效仿的抗风险优势。2023年的华东医药已经进入新的稳定增长期。2023年全年,核心子公司中美华东整体经营继续保持稳定增长趋势,实现营业收入(含CSO业务)33.99亿元,同比增长10.53%;实现合并归母净利润7.51亿元,同比增长11.67%。医药商业整体实现营业收入67.17亿元,同比下降1.86%,实现净利润1.07亿元,同比增长1.51%。医美业务整体继续保持良好增长态势,医美板块合计实现营业收入6.30亿元(剔除内部抵消),同比增长25.30%。工业微生物板块收入保持稳定增长,同比增长23.00%。
紧贴热点,华东医药重仓GLP-1R赛道
在持续的研发创新下,华东医药在抗肿瘤、内分泌和自身免疫三大核心治疗领域均已有全球首创新药(first-in-class)布局,并形成了ADC、GLP-1R、外用制剂三大特色研发矩阵,构筑差异化优势。论近两年最火热的靶点,莫过于GLP-1R,千亿降糖减肥市场引得众多企业争相布局。GLP-1R正巧落在了华东医药的主打领域,我们也看到了中国最全面的GLP-1布局。
华东医药在降糖/减肥领域围绕GLP-1R靶点进行了差异化布局,已构筑包括口服、注射剂在内的长效及多靶点全球创新药和生物类似药相结合的全方位产品管线:其中利拉鲁肽注射液是国内首个获批肥胖或超重适应症的GLP-1R产品;目前在研的还包括生物类似药司美格鲁肽注射液、全球创新口服小分子GLP-1R激动剂HDM1002、双靶点激动剂HDM1005及SCO-094、长效三靶点激动剂DR10624等多款产品。
1.国产首家:利拉鲁肽注射液
2023年3月30日,华东医药的利拉鲁肽注射液(商品名:利鲁平)用于控制成人2型糖尿病(T2DM)血糖的上市许可申请获批,是首款获批上市的国产利拉鲁肽注射液。2023年7月4日,利拉鲁肽注射液肥胖或超重适应症正式得到上市许可,拿下首个国产减肥针,有助于华东医药在减重赛道保持先发市场优势。
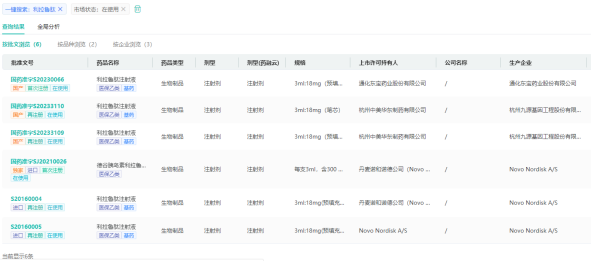
来源:药融云中国药品批文数据库
据药融云数据库,利拉鲁肽注射液近年院内市场销售额均在14亿元左右,目前仅有诺和诺德、华东医药、通化东宝三家企业拥有相关批文。

来源:药融云全国医院销售数据库
此外,复星医药旗下万邦生化、爱美客旗下诺博特生物的利拉鲁肽减肥临床也在推进中,分别处于三期和一期阶段。
2.华东医药司美格鲁肽III期临床,用于降糖!减肥适应症正在积极布局中
2023年9 月 20 日,华东医药宣布,其长效胰高血糖素样肽-1(GLP-1)受体激动剂司美格鲁肽注射液 III 期临床试验完成首例患者入组及给药。该研究是一项多中心、随机、开放、平行对照的III期临床研究,主要目的是在二甲双胍治疗后血糖控制不佳的2型糖尿病患者中论证试验药物司美格鲁肽注射液与对照药物司美格鲁肽注射液(诺和泰®)在治疗32周后血糖控制的等效性。预计2024年第四季度获得主要终点数据。
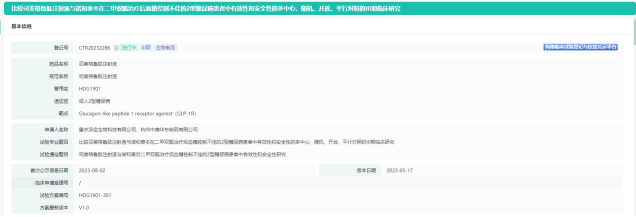
来源:药融云中国临床试验数据库
司美格鲁肽为GLP-1受体激动剂,GLP-1R类产品具有减肥、降糖和心血管获益等功效,是相对成熟稳定和安全的靶点。后续华东医药司美格鲁肽注射液也计划在国内启动用于肥胖或超重适应症的临床试验。
司美格鲁肽原研产品由诺和诺德开发。2021年4月,司美格鲁肽原研首次在中国获批上市,用于辅助饮食和运动以改善2型糖尿病(T2DM)患者的血糖控制,商品名为诺和泰®。分析师预测,到2024年,中国司美格鲁肽市场规模有望达到80亿元。
3.口服小分子GLP-1受体激动剂:HDM1002
HDM1002是华东医药自主研发的口服小分子GLP-1受体激动剂,临床前研究显示,HDM1002可强效激活GLP-1受体,诱导环磷酸腺苷(cAMP)产生,具有强效的改善糖耐受、降糖和减重作用并且显示出良好的安全性。
2023年5月,HDM1002糖尿病适应症首获中美双IND批准,并于2023年6月初实现首次人体试验(FIH)首例受试者用药,该研究旨在初步探索HDM1002片在人体的安全性和耐受性、药代动力学和剂量效应关系等(登记号:CTR20231505)。2023年9月13日,CDE官网显示,由杭州中美华东制药有限公司申报1类新药HDM1002片通过临床试验默示许可,适应症为:用于超重或肥胖人群的体重管理。

来源:CDE官网
HDM1002相关研究成果在2023年EASD大会上以口头报告的方式进行了展示。该研究从分子筛选、临床前药效、药动学、安全性等方面对HDM1002进行了介绍。HDM1002分子是公司全新的、拥有完全自主知识产权的口服小分子GLP-1受体激动剂,能够高选择性激动人GLP-1受体,促进胰岛素分泌,并在体内展现出强大的降血糖、控制摄食和减重的药效,此外HDM1002显著改善了口服生物利用度并展现出了优越的安全性。通过一系列临床前研究,评价了HDM1002的药效,药代动力学和安全性。在细胞水平,考察了HDM1002激活GLP-1R的细胞生物活性和选择性,在多个小鼠模型中评价了HDM1002降低血糖、减轻体重的药效作用,在小鼠、大鼠和食蟹猴中测定了HDM1002的药代动力学参数。在大鼠和食蟹猴中进行了安全性研究。
- 具有强效的GLP-1R激活作用:对GLP-1R的最大激活Emax与GLP-1(7-37)相当,是小分子完全激动剂。
- 具有高选择性:HDM1002对于GPCRs B族其他受体无作用。
- 优异的降糖药效:C57BL/6J-GLP-1R转基因小鼠中,HDM1002可抑制小鼠糖负荷后的血糖升高,可提高小鼠血浆胰岛素水平。
- 优异的减重药效:HDM1002能显著降低C57BL/6J-GLP-1R DIO小鼠的体重、随机血糖和空腹血糖,并具有较好的剂量相关性。
- 显著改善的生物利用度:HDM1002在小鼠、大鼠、食蟹猴体内的生物利用度达到31.5-114%。
- 优越的安全性:HDM1002对中枢神经系统、心血管系统、呼吸系统无明显影响,心脏毒性风险显著降低,安全窗显著提升。

4.双靶点GLP-1R/GIPR激动剂:SCO-094和HDM1005
SCO-094(HDM1003)2023年年2月,华东医药获得日本SCOHIA PHARMA公司研发的药物SCO-094及其衍生产品的全球(含日本)独家开发、生产和商业化权利。该药物与礼来公司的替尔泊肽一起针对 GLP-1R 和 GIP 等双重受体,并已在英国成功进行了 I 期临床试验。临床前研究证明了 SCO-094 对预期靶标的强结合活性和生物学效应。动物模型显示其具有降低血糖、促进减肥、改善肝功能、降低甘油三酯和抑制肝脂肪变性的功效。临床前数据支持 SCO-094针对糖尿病、减肥和 NASH 等适应症的临床开发。该药物目前正在英国进行I期临床试验。

来源:药融云全球药物研发数据库
HDM1005是一种长效多肽双靶点激动剂,靶向GLP-1R/GIPR,用于治疗糖尿病和肥胖症。公司目前正在进行该产品的临床I期研究。临床前研究显示,HDM1005 可通过激活 GLP-1 受体和 GIP 受体,促进胰岛素释放,抑制食欲,发挥显著的改善糖耐量、降糖和减重效果;同时,现有数据显示 HDM1005 具有良好的成药性和安全性。

来源:药融云中国临床试验数据库
5.长效GLP-1R/GCGR/FGF21R三靶点激动剂:DR10624
2023年5月18日,CDE官网显示,华东医药旗下道尔生物已提交国内首个“注射用DR10624”临床申请,并已获受理。值得注意的是,DR10624是全球首个进入临床开发阶段的同类药物。
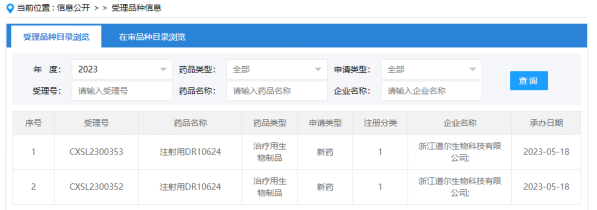
来源:CDE官网
DR10624为全球首创(first-in-class)的一种靶向GLP-1受体(GLP-1R)、GCG受体(GCGR)和FGFR1c/Klothoβ(FGF21R)的长效三靶点激动剂。由N端靶向GLP-1R/GCGR的嵌合肽段与工程化改造的IgG1Fc融合,并在Fc的C末端融合重组的FGF21突变体。DR1024由中国仓鼠卵巢(CHO)细胞表达,经纯化后获得。DR10624结构上为对称二聚体,具有GLP-1R、GCGR与FGF21R三重激动剂的生物学活性,同时融合有去糖基化改造的IgG1Fc以延长半衰期。临床前的动物研究显示,DR10624具有明显的降脂、减重、降糖等疗效。
DR10624已于2023年7月在新西兰完成了治疗肥胖症的I期多次递增剂量给药(MAD)临床试验的首例受试者给药。8月31日,DR1062在国内也启动了评价DR10624单次和多次皮下给药、剂量递增的安全性、耐受性、药代动力学和药效学的随机、安慰剂对照、双盲、Ⅰ期研究,适应症为超重或肥胖人群的体重管理(登记号:CTR20232684)。

来源:药融云中国临床试验数据库
结语
GLP-1R药物的研发在国内外均吸引众多药企的布局,利拉鲁肽、度拉糖肽、司美格鲁肽、替尔泊肽四款产品的商业化成功彻底点燃了该赛道的研发热情。降糖减重的千亿美元市场有着无限的想象空间,华东医药在GLP-1R药物的多方位的布局非常值得国内其他药企学习。红海市场将至,华东医药已做好充足准备,6款GLP-1R药物有望使其再次腾飞。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论