
4月26日,诺华宣布其盐酸伊普可泮胶囊(iptacopan)在华获批上市,主要用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者。(相关阅读:诺华2024Q1财报:净销售额达118亿美元,同比增长11%)
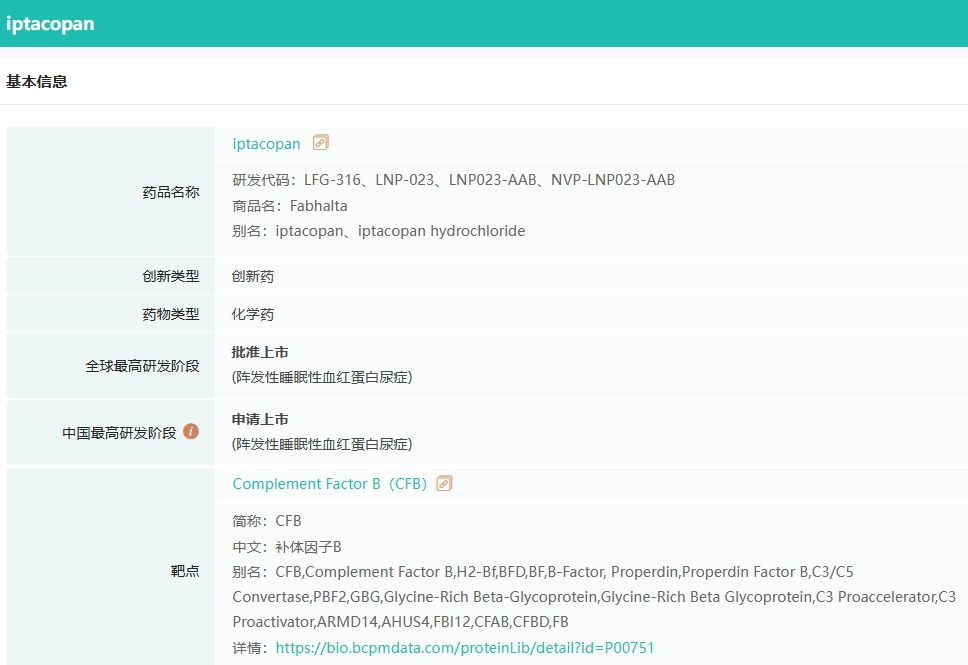
截图来源:药融云全球药物研发数据库
伊普可泮是诺华研发的first-in-class,是一款靶向补体旁路途径B因子的口服抑制剂。其独特之处在于作用于C5末端通路的上游,能够同时控制血管内溶血和血管外溶血,从而有效弥补了抗C5抗体的不足。更重要的是,它为患者提供了口服单药的便捷选择,极大地改善了治疗体验。

截图来源:药融云全球药物研发数据库
2023年12月,伊普可泮凭借其卓越疗效获得了FDA的批准上市,用于成人PNH患者的治疗。这一里程碑式的突破标志着伊普可泮成为首个获FDA批准的口服单药治疗成人PNH的药物,为业界树立了新的标杆。在FDA获批仅4个月后,伊普可泮在中国成功获批,这是诺华以“中国速度”推动全球创新药物加速进入中国的又一例证。
中国对伊普可泮的批准是基于一项具有关键意义的全球III期APPOINT-PNH临床研究及其中国亚组数据的支持,其中中国受试者占据了50%的比例。该研究结果充分证明了伊普可泮在未接受过补体抑制剂治疗的成人PNH患者中展现出的卓越疗效、安全性及良好的耐受性。接受治疗24周后,大多数患者的血红蛋白水平成功提升至12g/dL或以上,几乎全部患者成功避免了输血需求,同时患者报告的疲劳症状也得到了显著缓解。
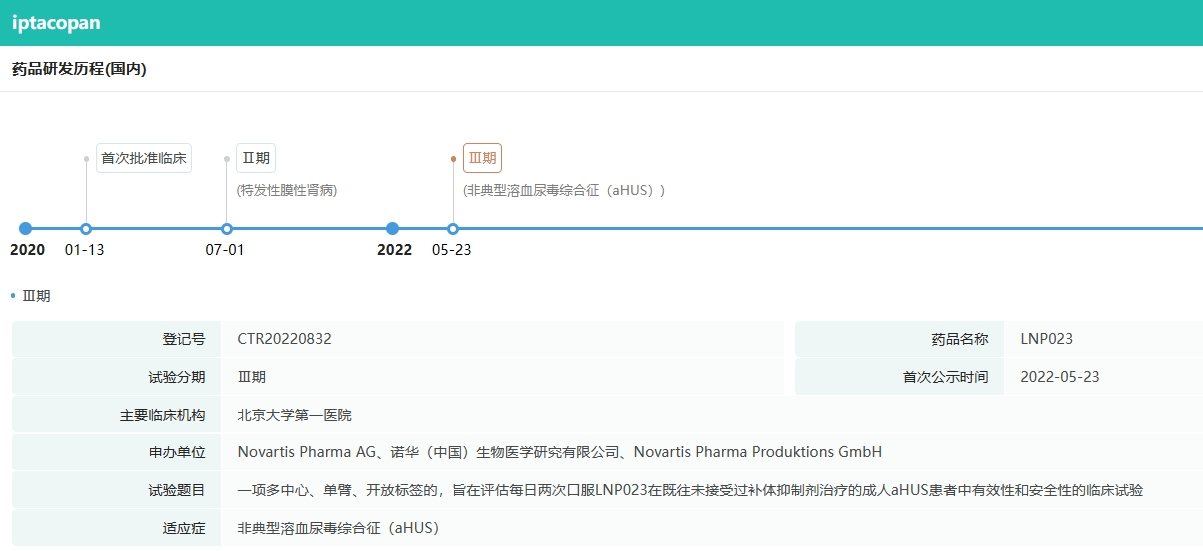
截图来源:药融云全球药物研发数据库
阵发性睡眠性血红蛋白尿症(PNH)是一种罕见的慢性血液疾病,其发病机理与补体介导作用密切相关。据统计数据显示,PNH的发病率约为百万分之一至二,且亚洲人群的发病率相对较高,该疾病可在任何年龄段发生,但尤以30-40岁人群为多见。PNH患者体内存在PIG-A基因突变,导致血细胞表面缺乏关键的补体调节蛋白CD55和CD59,从而使得细胞更易于受到补体系统的攻击。其临床表现主要包括溶血性贫血、骨髓造血功能衰竭以及血栓形成等症状。
尽管抗补体C5疗法(如依库珠单抗或Ravulizumab)过去一直是国际公认的PNH标准治疗方案,但许多患者在接受抗C5治疗后仍面临残留贫血、疲乏以及输血依赖等问题,这极大地影响了他们的生活质量。而伊普可泮的获批为中国PNH患者提供了新的治疗选择,有望帮助他们更好地管理疾病,提高生活质量。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论