
近日,Jaguar Gene Therapy宣布,美国食品和药物管理局(FDA)已经批准了该公司的其研发中的AAV基因疗法JAG201的IND申请,该疗法旨在针对由SHANK3基因变异或缺失所引发的严重神经发育疾病,覆盖了遗传性自闭症谱系障碍(ASD)和Phelan-McDermid综合症(PMS)。


目前,美国约有3万名ASD或PMS患者存在SHANK3突变或缺失,没有任何治疗方法。SHANK3基因缺陷会导致神经突触功能障碍,破坏神经元之间的通信。具体来说,该基因缺陷会减少兴奋性突触处的几种关键受体和信号蛋白的含量,导致神经突触形成和功能受损,由于正常的突触功能是所有神经元生理机能,包括高级认知功能和学习所必需的前提条件,因此,SHANK3基因缺陷会引发严重的神经系统疾病。
JAG201通过AAV9载体递送缩小版的功能性SHANK3基因,靶向中枢神经系统的神经细胞,该疗法通过一次性单侧脑室注射给药,可将药物有效递送至整个大脑和脊髓,通过提供适当水平的SHANK3基因表达,可持久恢复支持学习和记忆所需的突触功能,从而有效改善神经发育以及维持认知、沟通、社交和运动等技能。
公司计划于今年下半年在美国启动一项I期试验,研究对象是SHANK3突变或缺失的ASD或PMS成人患者。
Jaguar Gene Therapy首席执行官Joe Nolan说:"我们很高兴获得FDA批准,将SHANK3 基因疗法推向临床。临床前数据表明,JAG201有可能改变那些患有这种疾病的人的命运。对于约3万名患有ASD或PMS的患者来说,这更是一个重要的里程碑,这些患者可能会出现一系列临床表现,包括全面发育迟缓、言语和交流障碍,以及认知、社交和运动功能障碍恶化,最终需要 24 小时护理和监护。目前,还没有从根本上解决问题的治疗方案,我们希望能改变这种状况"。
Jaguar Gene Therapy是一家处于临床阶段的生物技术公司,致力于为严重遗传疾病患者加快基因治疗的突破性进展,包括那些影响大量患者群体的疾病。公司正在快速推进由三个项目组成的初始管线。公司领先的 IND批准项目针对 SHANK3 基因突变或缺失引起的严重神经发育障碍,包括ASD或PMS。第二个管线项目针对1型半乳糖血症,第三个针对1型糖尿病。Jaguar与即将从Jaguar分拆出来的Advanced Medicine Partners公司合作生产治疗药物。Jaguar的主要投资者包括Deerfield Management Company、ARCH Venture Partners 和礼来公司。
研发管线查询
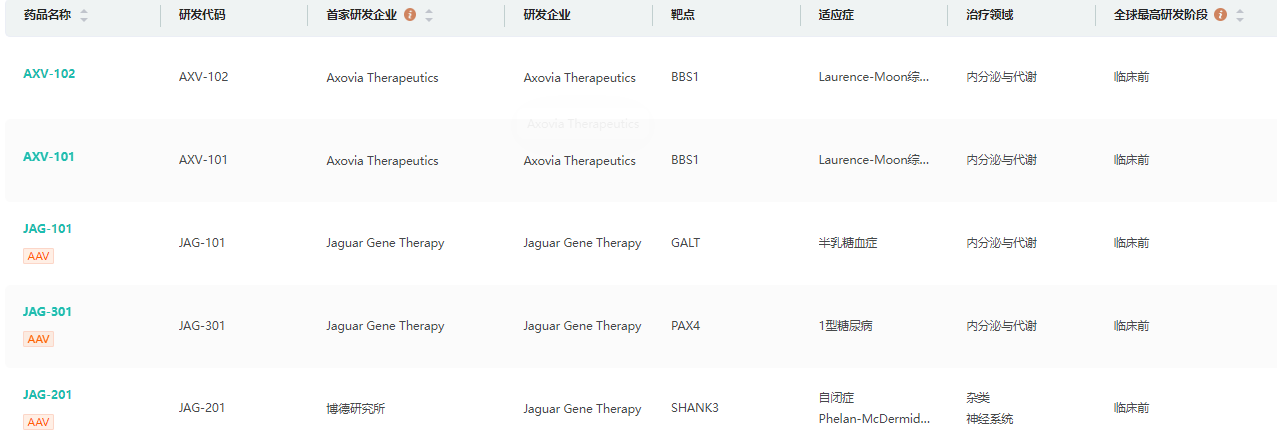
截图来源:药融云全球药物研发数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论