
2023年11月22日,信达生物宣布其在研药物GLP-1R/GCGR双重激动剂玛仕度肽(研发代号:IBI362)在中国2型糖尿病受试者中的II期临床研究结果全文近日在国际权威糖尿病期刊Diabetes Care在线发表。

玛仕度肽(IBI362)是信达生物与Lilly共同推进的一款胰高血糖素样肽-1受体(GLP-1R)/胰高血糖素受体(GCGR)双重激动剂。玛仕度肽已在多项临床研究中展现出优秀的减重和降糖疗效,以及降低腰围、血脂、血压、血尿酸、肝酶及肝脏脂肪含量,以及改善胰岛素敏感性,带来多重代谢获益。
信达生物预计2023年底至2024年初递交6mg剂量版本减重适应症上市申请,2024年递交2型糖尿病的上市申请,同时在探索更多适应症,包括NASH等。作为当下热度最高的的GLP-1R赛道,玛仕度肽展现出了同类最佳的潜力。
10款商业化产品,助力信达生物成为biopharm
信达生物已有10个产品获得批准上市(含自主研发和商业合作),它们分别是信迪利单抗注射液(达伯舒®),贝伐珠单抗注射液(达攸同®),阿达木单抗注射液(苏立信®),利妥昔单抗注射液(达伯华®),佩米替尼片(达伯坦®),奥雷巴替尼片(耐立克®), 雷莫西尤单抗注射液(希冉择®),塞普替尼胶囊(睿妥®),伊基奥仑赛注射液(福可苏®)和托莱西单抗注射液(信必乐®)。2021年12月,达伯舒®成为唯一一个拥有包含一线非鳞状非小细胞肺癌、一线鳞状非小细胞肺癌、一线肝癌及霍奇金淋巴瘤在内的四项适应症获批,并均被纳入国家医保的PD-1抑制剂。
2022年6月,达伯舒®(信迪利单抗注射液)第五项适应症一线食管鳞癌、第六项适应症一线胃及胃食管交界处腺癌在中国获批,达伯舒®成为唯一在五大高发瘤种一线治疗均获批的PD-1抑制剂。2023年1月,达伯舒®新增胃癌和食管癌两项适应症纳入国家医保目录,达伯舒®成为唯一纳入国家医保目录的胃癌PD-1抑制剂,也是唯一将五大高发瘤种一线治疗均纳入国家医保目录的PD-1抑制剂。
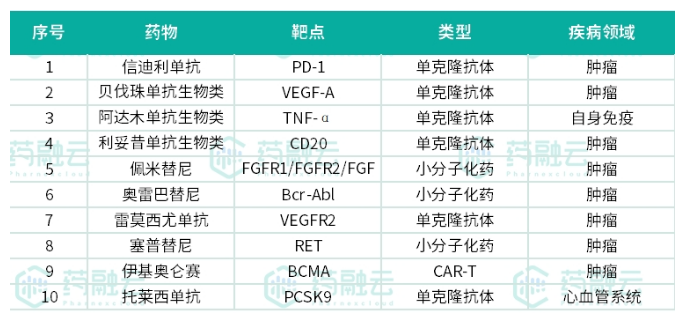
来源:药融云企业版数据库
2023年11 月 2 日,信达公布 2023 第三季度业绩,总产品收入超人民币 16 亿元,同比取得超过 45% 的强劲增长,今年前三季度实现总产品收入达约41亿元。据礼来公布的财报数据,PD-1 单抗信迪利单抗前三季度销售额约为 2.8 亿美元(约合人民币20亿元),同比增长 19%;Q3 销售收入 1.15 亿美元,同比增长 50%。
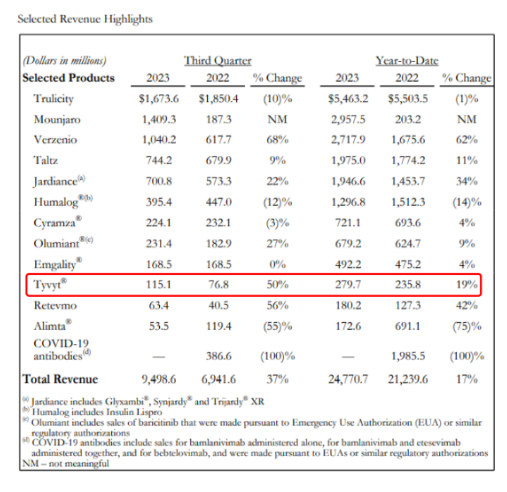
来源:礼来公司财报
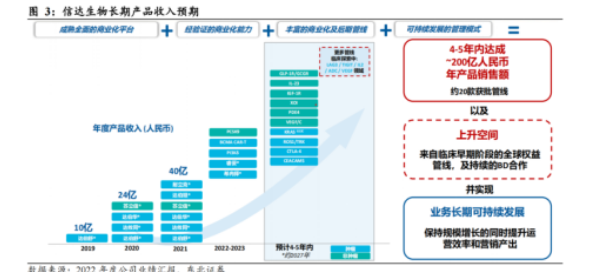
2023年上半年业绩报告会上,信达生物再次强调去年提出的目标:未来五年达到200亿元产品收入。
信达新上市品种里,托莱西单抗是国产首款PCSK9抑制剂,这款新药曾被寄予厚望。但面对PCSK9赛道激烈的竞争,特别是随着诺华靶向PCSK9的siRNA药物Inclisiran上市,托莱西单抗并未展现出优势。在研品种里,还有心血管及代谢、自免、眼科等重磅药物。其中,减重药物GLP-1R/GCGR双重激动剂玛仕度肽是目前最被外界看好的潜力增长点。
降糖减重两手抓!减重效果超司美格鲁肽
2023年10月30日,信达生物宣布,玛仕度肽高剂量9mg在中国肥胖受试者中的2期临床研究继24周主要研究终点达成后,完成48周治疗期,玛仕度肽9mg组体重较基线的平均变化值与安慰剂组的差值达−17.8kg(近36斤)。有51.2%的受试者体重较基线下降15%以上,34.9%的受试者体重较基线下降20%以上。这一成绩使得玛仕度肽在减重效果方面优于此前的司美格鲁肽注射液。
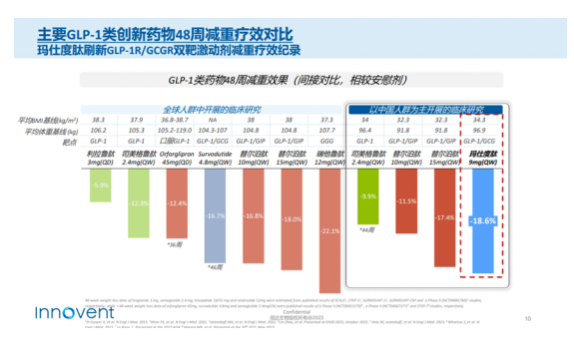
目前,玛仕度肽4mg和6mg在中国超重或肥胖(GLORY-1)受试者和2型糖尿病(DREAMS-1和DREAMS-2)受试者中的三项3期注册研究正在进行中。信达生物计划将于2023年底启动玛仕度肽9mg在中国肥胖受试者中的3期临床研究。
全球已经上市的12款GLP-1R药物
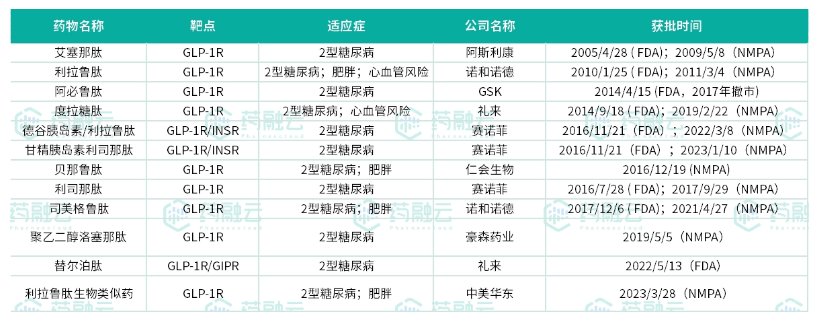
目前全球共有12款GLP-1R药物上市,中国一共批准了10款(仅有仁会生物的贝那鲁肽和中美华东的利拉鲁肽生物类似药获批了肥胖适应症)。从研发进度来看,玛仕度肽6mg剂量组大概率在今年底或明年初读出三期完整临床数据,预计在2024年底或2025年初有望正式获批上市,成为国内最具市场潜力的减重药物。根据相关机构预测,玛仕度肽销售额峰值有望突破50亿元。
总结
5年内冲击年营收200亿,是一个非常宏大的目标!信达生物的研发能力是非常值得肯定的,但要实现年营收200亿,商业化能力更是重中之重。信达已建立起一条拥有涵盖癌症、代谢、自身免疫、眼科及其他主要治疗领域的逾 30 款新药品种的创新产品管线。相信随着玛仕度肽等新药的上市,信达生物会逐步实现自己的预定目标,朝着bigpharm进发。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论