
追踪全球创新药研发进展,展望医药行业未来发展趋势。据药融研究院出品的《药融云医药行业观察周报》统计,在2023.11.06-2023.11.12期间,ADC疗法、抗VEGF-A/Ang-2双抗、PD-1/CTLA-4双抗、ALK抑制剂等创新药物有最新进展,涉及胃癌、肿瘤、肺癌、高血压等疾病治疗。
1. 重磅ADC「德曲妥珠单抗」胃癌适应症拟纳入优先审评
近日,第一三共(DaiichiSankyo)申请的注射用德曲妥珠单抗新适应症拟纳入优先审评,单药适用于治疗既往接受过两种或两种以上治疗方案的局部晚期或转移性HER2阳性成人胃或胃食管结合部腺癌患者。
德曲妥珠单抗(Enhertu,优赫得)是阿斯利康(AstraZeneca)和第一三共联合开发的一款靶向HER2的抗体偶联药物(ADC),于2022年4月被国家药品监督管理局药品审评中心纳入突破性治疗品种名单与优先审评,2023年2月在中国获批,用于治疗HER2阳性和HER2低表达成人乳腺癌患者。
HER2是一种酪氨酸激酶受体,它表达在许多肿瘤类型中,包括乳腺癌、胃癌和结直肠癌。德曲妥珠单抗由靶向HER2的人源化单克隆抗体通过四肽可裂解连接子与拓扑异构酶1抑制剂有效载荷连接组成。该药的作用机理为:首先通过药物中的抗体部分靶向并附着于癌细胞上的HER2;然后德曲妥珠单抗会进入癌细胞,释放化疗药物,ADC中的化疗部分可以杀死癌细胞以及附近的其它细胞。
阿斯利康在研ADC产品管线查询
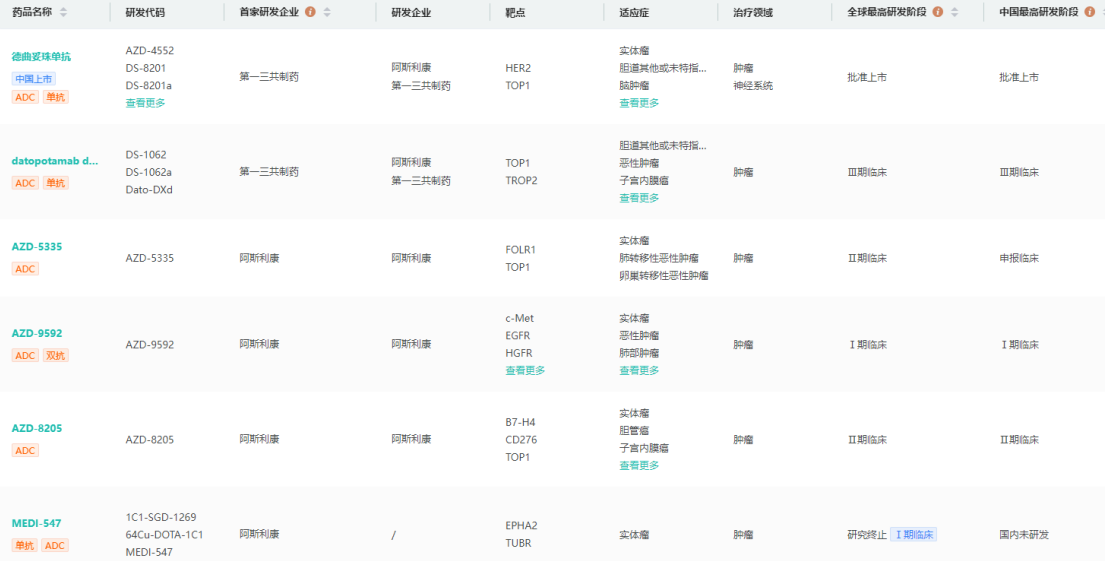
图片来源:药融云全球药物研发数据库
药融云数据库显示,十年前,阿斯利康就已开启了在ADC领域的前瞻性布局,占尽先机。截止2023年5月,阿斯利康通过“并购+BD+自研”,目前的研发管线中已积累了18款在研ADC产品,其中包括2款上市,1款处于临床III期,2款处于临床II期,7款处于临床I期,1款处于临床前。其与第一三共合作开发的DS-8201销售额势如破竹,2022年全年营收约合12.38亿美元,同比上涨191%!
2.信达生物公布2款双靶点眼科新药最新临床数据
信达生物在2023年美国眼科学会(AAO)年会上公布了两项最新临床研究结果,分别为抗VEGF-抗补体双靶点药物(IBI302)治疗新生血管性年龄相关性黄斑变性(nAMD)的临床2期数据,以及抗VEGF-A/Ang-2双特异性抗体(IBI324)治疗糖尿病性黄斑水肿(DME)的临床1期数据。
研究结果显示,信达生物的两款眼科产品IBI302和IBI324分别在nAMD和DME患者中展现出良好的疗效,未识别新的安全性风险信号。据悉,目前高剂量IBI302 的III期临床试验已经启动,并完成了首例受试者给药。除了关注视力和视网膜水肿改善,还将探索IBI302在长间隔给药、抗黄斑萎缩与视网膜纤维化的潜力。
药融云数据库显示,信达生物产品管线涵盖单克隆抗体、多特异性抗体、免疫细胞因子、T/NK细胞、ADC、融合蛋白、细胞治疗及小分子药物等,已获批上市9款产品,2022年营收达44.4亿元。
值得一提的是,信达生物管线中已有12个双特异性抗体药物进入临床,领跑其他国内药企,涉及PD-(L)1、VEGF、CD47、HER2、Claudin18.2、TIGIT等热门靶点,集中在抗肿瘤及眼科两大治疗领域。其中,其自主研发的有IBI-322(靶点PD-L1/CD47)、IBI-323(靶点LAG-3/PD-L1)、IBI-389(靶点CLDN18.2/CD3)和IBI-363(靶点PD1/IL2)等。
信达生物双特异性抗体药物研发进度查询

图片来源:药融云全球药物研发数据库
3.康方生物PD-1/CTLA-4双抗3期研究达终点
康方生物研发的PD-1/CTLA-4双特异性抗体卡度尼利单抗(开坦尼,代号AK104-302)的随机、双盲、多中心3期研究期中分析中达到主要研究终点。该试验旨在评估卡度尼利单抗联合奥沙利铂和卡培他滨(XELOX)对比安慰剂联合XELOX作为一线治疗不可手术切除的局部晚期或转移性胃腺癌或胃食管结合部腺癌(GC/GEJC)的有效性与安全性。独立数据监察委员会(IDMC)建议基于期中分析结果提前提交卡度尼利单抗该适应症的新药上市申请。
卡度尼利单抗是一款创新的PD-1/CTLA-4双特异性肿瘤免疫治疗药物,于2022年6月在国内获批上市,用于既往接受含铂化疗治疗失败的复发或转移性宫颈癌患者的治疗。作为一种基于PD-1免疫检查点的全新双特异性抗体新药,卡度尼利单抗可以充分发挥PD-1和CTLA-4两个免疫检查点的协同抗肿瘤作用,同时副作用较两个靶点的单抗联合治疗明显降低,优异的抗肿瘤疗效和安全性将为全球广大肿瘤患者带来切实的临床获益提升。
4.罗氏ALK抑制剂「阿来替尼」拟纳入优先审评
罗氏(Roche)申请的盐酸阿来替尼胶囊拟纳入优先审评,拟定适应症为:用于间变性淋巴瘤激酶(ALK)阳性非小细胞肺癌(NSCLC)患者肿瘤完全切除后术后的辅助治疗。阿来替尼针对该适应症已于今年10月获得CDE纳入突破性治疗品种。
肺癌是全球常见的一种癌症,NSCLC在肺癌中占比约为85%。对于ALK阳性NSCLC患者(尤其是早期患者)而言,延缓疾病进展尤其重要,一方面是因为该群体的年龄相对较年轻,约为55岁;另一方面是因为该群体相较于其他类型的NSCLC更易发生脑转移。
阿来替尼是罗氏开发的一款新一代ALK抑制剂。此前已于2018年在中国获批上市,用于治疗ALK阳性的局部晚期或转移性NSCLC。本次获CDE拟纳入优先审评的申请针对的是一项新适应症:用于ALK阳性NSCLC患者的术后辅助治疗。10月18日,阿来替尼已在一项针对ALK阳性NSCLC患者术后辅助治疗的3期ALINA研究中达到主要终点。
阿来替尼中国临床试验信息查询
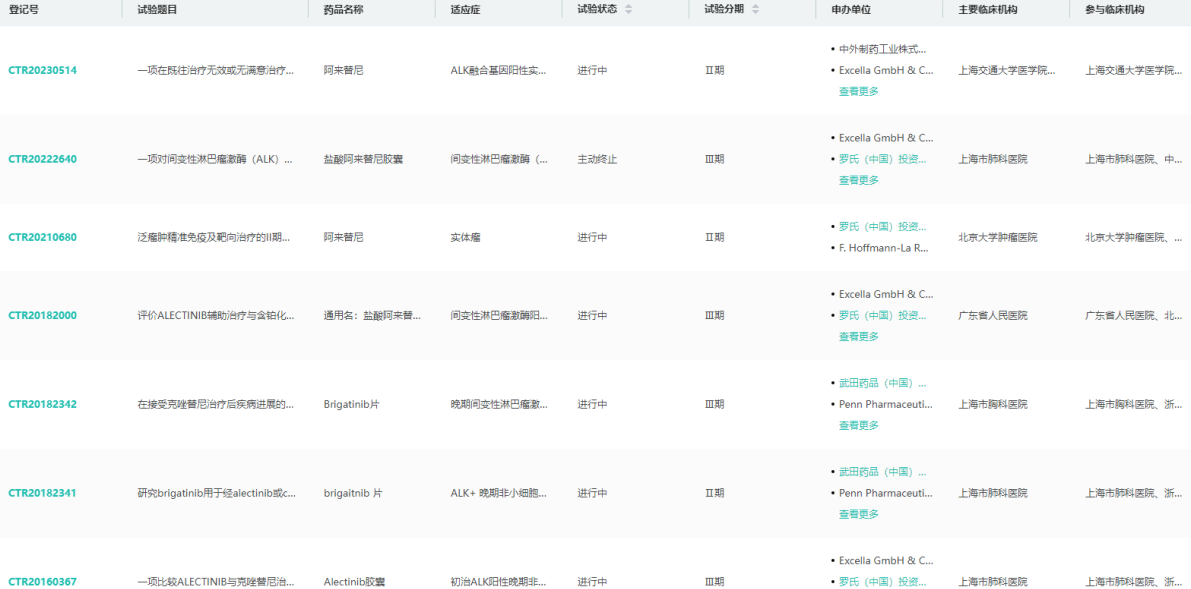
图片来源:药融云中国临床试验数据库
5. 不用吃药有效降低高血压!首款创新疗法获FDA批准
大冢医疗器械公司(OtsukaMedicalDevices)及其子公司RecorMedical宣布,美国FDA已批准Recor的Paradise超声肾脏去神经支配(RDN)系统用于高血压的治疗。
Paradise超声肾脏去神经支配系统是首个获美国FDA批准的创新高血压疗法。ParadiseRDN系统旨在作为生活方式改变和药物不能充分控制患者血压时的辅助治疗选择。它是基于超声RDN技术所开发的“first-in-class"疗法,旨在通过抑制肾动脉周围的交感神经来降低血压,从而减少可能导致高血压的过度激活。RDN系统通过每条主要肾动脉向外周神经提供两到三剂360度超声能量(每次持续七秒)来达到神经抑制目的。Paradise导管采用独特的HydroCooling系统,该系统在手术过程中通过球囊导管循环无菌水,以帮助保护肾动脉壁。
<END>
关注《药融云医药行业观察周报》,实时了解更多全球创新药物的最新进展。想要获取报告更多详细内容,关注“药融云”公众号,后台回复“报告”关键词,领取完整报告。





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论