
10月19日,CDE官网显示,同意按优先审评范围“(五)符合附条件批准的药品”,拟将德琪医药提交的塞利尼索片上市申请纳入优先审评,拟定适应症为:适用于既往接受至少2线系统性治疗后,复发性或难治性弥漫性大B细胞淋巴瘤(DLBCL),包括由滤泡性淋巴瘤转化的DLBCL成人患者。

截图来源:CDE官网
塞利尼索片是全球首个全新机制的口服选择性核输出蛋白(XPO1)抑制剂,最早于2019年获FDA批准上市,用于治疗复发或难治性多发性骨髓瘤;2020年获批多项新适应症,后销售额快速走高,2020年突破亿元美元大关。塞利尼索由Karyopharm Therapeutics公司研发,德琪药业通过引进的方式获得其中国地区的商业化权益。这也是德琪医药首个上市商业化的产品。
塞利尼索全球销售额

截图来源:药融云全球药物研发数据库
今年8月,德琪医药和翰森制药就在中国大陆商业化塞利尼索等包含或由塞利尼索组成的产品达成合作协议,总金额为7.35亿元,包括2亿元首付款和最高5.35亿元的里程碑付款。据悉,该产品20mg*12片/盒在中国售价14135元,20mg*16片/盒售价18649.67元。
2021年12月,塞利尼索片通过NMPA优先审评程序,获批联合地塞米松用于治疗既往接受过治疗且对至少一种蛋白酶体抑制剂,一种免疫调节剂以及一种抗CD38单抗难治的复发难治性多发性骨髓瘤(R/RMM)。
塞利尼索部分适应症研发状态
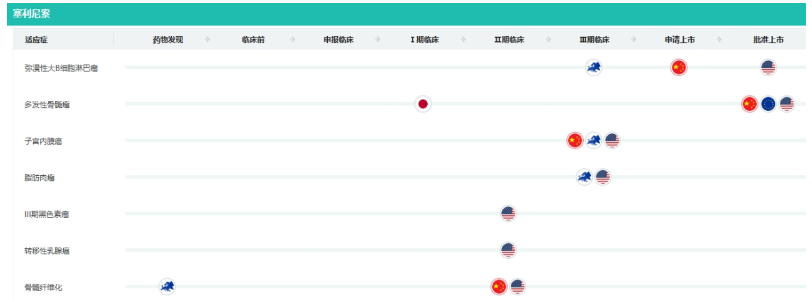
截图来源:药融云全球药物研发数据库
据药融云数据库,塞利尼索还布局有子宫内膜癌、脂肪肉瘤、黑色素瘤、乳腺癌等多个癌种的适应症。其中,骨髓纤维化、复发/难治性弥漫性大B细胞淋巴瘤和复发/难治性惰性非霍奇金淋巴瘤、外周T细胞淋巴瘤等适应症在国内已进入临床II期阶段。
此外,据德琪医药2022年报显示,除塞利尼索外,德琪医药已进入临床阶段的管线产品还有8个,其中进展最快的是ATG-008,其联合特瑞普利单抗用于宫颈癌和晚期实体瘤已处于2期临床。

图片来源:德琪医药2022年报
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论