
近期,美国FDA拒绝批准礼来用于治疗中度至重度特应性皮炎(湿疹)的lebrikizumab生物许可申请(BLA),原因是在一家第三方制造商中发现了问题。来自美国监管机构的完整回应函(CRL)中没有提到对lebrikizumab的临床数据、安全性或标签的担忧,这增加了延迟不会太久的希望——假设CMO的问题可以解决或生产转移到新的合作伙伴。

礼来公司表示,CMO参与了单克隆抗体药物的生产,该公司表示,没有其他药物受到CRL的影响。该公司表示,将“继续与第三方制造商和FDA密切合作,以解决反馈意见,使患者能够获得lebrikizumab。”
这一延迟对赛诺菲和Regeneron来说是一种提振,赛诺菲和Regeneron的重磅产品IL-4和Il-13抑制剂Dupixent (dupilumab)目前引领特应性皮炎市场,根据Evaluate的估计,lebrikizumab此前被预测到2028年将达到15亿美元。这仍然远远低于Dupixent预计的70亿美元特应性皮炎销售高峰,但lebrikizumab仍然是礼来公司的重要新产品,也是该公司表示将于今年推出的四种新药之一。
2020年礼来斥资11亿美元收购了Dermira,从中获得了lebrikizumab。
lebrikizumab基本信息
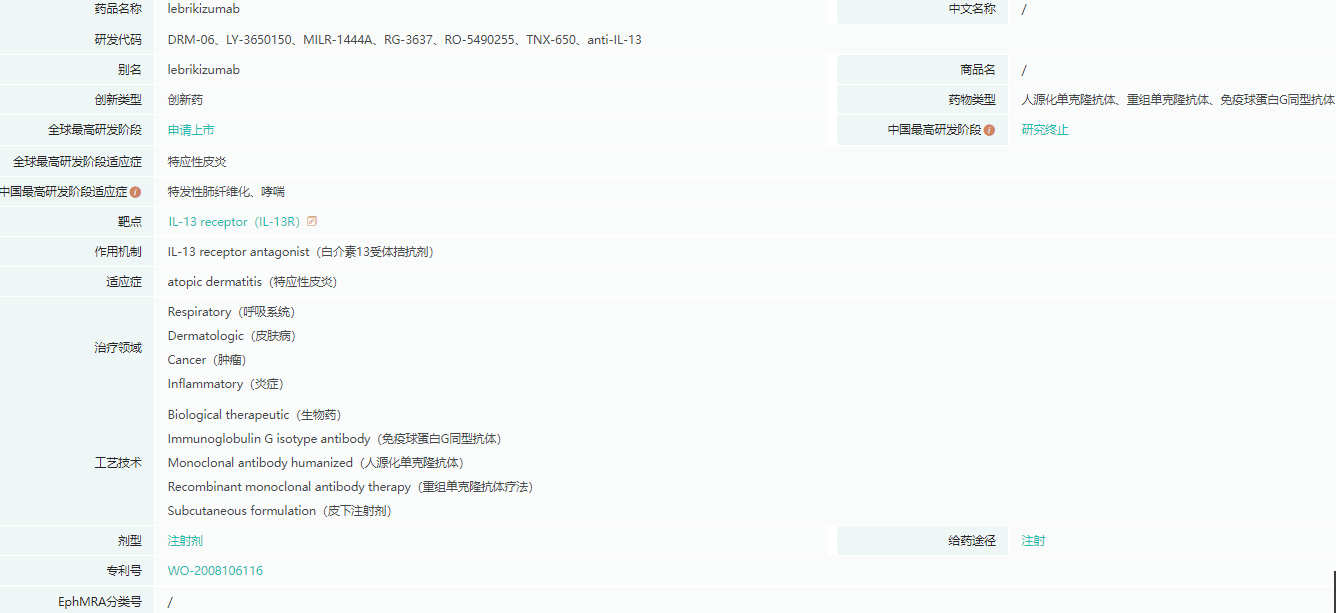
截图来源:药融云全球药物研发数据库
这是礼来公司在2023年因生产问题收到的第二次CRL。今年4月,由于生产问题,FDA再次拒绝了用于针对中至重度溃疡性结肠炎(UC) IL-23p19 单抗mirikizumab的批准。
Mirikizumab 是礼来在研的一款IL-23p19 单抗,刚于今年 3 月在日本获批上市,针对中至重度溃疡性结肠炎(UC),成为首款治疗 UC 的 IL-23p19 抗体。今年5 月礼来宣布收到了FDA 发出的完整回复函,FDA 表示对 Mirikizumab 生产制造过程存在疑问,但并未提及功效与安全性相关问题。礼来表示将继续与 FDA 积极合作,争取尽快在美国上市。
据药融云数据,今年7月24 日,CDE 拟将礼来 Mirikizumab 注射液纳入突破性疗法,拟用于治疗中重度活动性克罗恩病(CD)成人患者。
参考资料:
[1]https://investor.lilly.com/news-releases/news-release-details/us-food-and-drug-administration-issues-complete-response-2
[2]https://endpts.com/FDA-rejects-eli-lillys-eczema-drug-lebrikizumab-due-to-third-party-manufacturing-issues/
[3]药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论