
2023年9 月 20 日,据 CDE 官网显示,信达生物递交的 IBI363 临床试验申请获默示许可,联用贝伐珠单抗或仑伐替尼或呋喹替尼或/和化疗用于晚期肿瘤(受理号:CXSL2300471)。IBI363 是由信达生物自主研发的潜在同类首创(First-in-Class)新药,有效成分为 PD-1/IL-2 双特异性抗体融合蛋白。

截图来源:CDE官网
信达生物已经有12款双抗新药进入临床阶段,包括对PD-1/PD-L1、PD-1/HER2、PD-L1/CD47、PD-L1/LAG-3、PD-1/4-1BB、PD-1/TIGIT、Claudin18.2/CD3、VEGF/Ang2、VEGFA/VEGFC、EGFR/B7H3等多种靶点的双抗药物。其中有双抗正在如火如荼的进行临床,也有一些正在慢慢“消失”(暂无后续进展)。
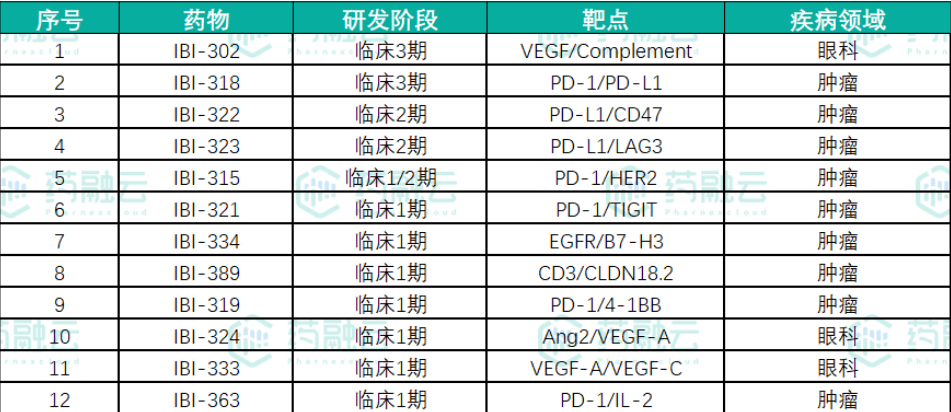
来源:药融云全球药物研发数据库
1.眼科VEGF/Complement双抗:IBI-302
IBI-302是一种双靶向特异性重组全人源融合蛋白。N端为VEGF结合域,能够与VEGF家族结合阻断VEGF介导的信号通路,抑制血管内皮细胞的生存、增殖,从而抑制血管新生,降低血管渗透性,减少血管渗漏;C端为补体结合域,能够通过特异性结合C3b和C4b,抑制补体经典途径和旁路途经的激活,减轻补体活化介导的炎症反应。IBI302可能通过同时抑制VEGF介导的新生血管生成和补体活化通路,发挥治疗作用,针对的适应症为:新生血管性年龄相关性黄斑变性。目前IBI-302正在国内进行三期临床。

截图来源:药融云中国临床试验数据库
此前,IBI-302的Ib期在2021年美国眼科年会上发表。IBI302的Ib期研究是一项随机、开放、阳性对照、多中心、重复给药、剂量递增的临床研究,旨在评估nAMD患者中多次玻璃体腔注射IBI302后的安全性和耐受性。
已经完成的Ib期临床研究共纳入18例受试者,所有受试者随机接受多次玻璃体腔注射IBI302或阿柏西普眼内注射溶液。该临床研究未报告剂量限制性毒性,未发生与研究药物相关的不良事件及严重不良事件,展现出了IBI302良好的安全性与耐受性。三次负荷治疗后的4周时,可观察到受试者视力提高以及视网膜水肿的减轻:IBI302组的12例受试者中最佳矫正视力较基线提高平均提高6.4个字母,平均中央区视网膜厚度较基线减少129.3微米。其中,4mg IBI302组,视力提高了8.0个字母,平均中央区视网膜厚度改善了134.3微米。
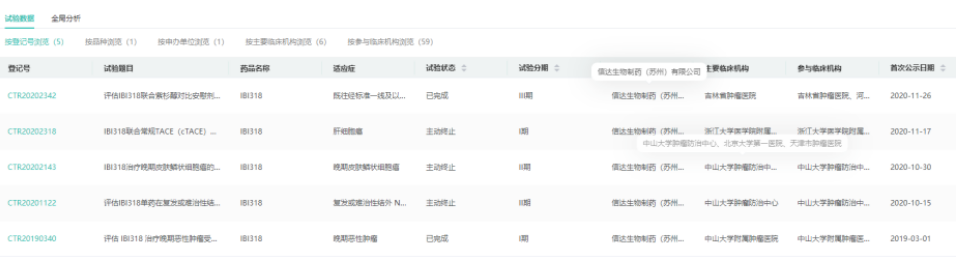
2.PD-1/PD-L1双抗:IBI-318(消失)
IBI-318是由礼来公司与信达生物共同发现,并由信达生物负责在中国进行开发。IBI-318同时阻断PD-1及PDL1信号转导途径,并增强免疫突触的形成,从而加强抗肿瘤活性。IBI-318为全球首个PD1/PDL1双抗类在研药,最高研发阶段为临床三期。但根据2022年业绩报披露和官网现有在研管线,我们发现IBI-318已不见踪影。根据药融云中国临床试验数据库,IBI-318一共在国内开展了5项临床试验,其中3项临床试验被主动终止,2项临床试验已完成,但未公布相应完整的临床试验数据。
3.PD-L1/CD47双抗:IBI-322
IBI-322是由信达生物制药自主开发的特异性针对CD47/PD-L1靶点的重组双特异性抗体。本候选产品可靶向肿瘤细胞表面CD47,阻断SIRPα/CD47信号通路,激活巨噬细胞对肿瘤细胞的吞噬作用;还能结合肿瘤细胞表面PD-L1,阻断PD-1/PD-L1信号通路,解除肿瘤微环境对T细胞抑制,激活T细胞对肿瘤细胞的杀伤作用。目前IBI-322最高研发阶段为临床2期。
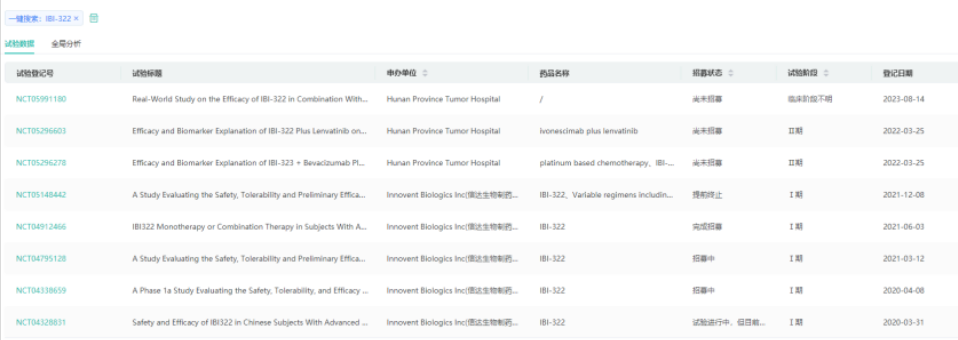
截图来源:药融云全球临床试验数据库
2023年8月13日,《OncLive》医学在线期刊公布了CD47/PD-L1双特异性抗体IBI322治疗PD-1/PD-L1耐药的经典霍奇金淋巴瘤的I期疗效数据。试验结果显示,在所有患者(n=23)中,IBI322单药治疗的客观缓解率(ORR)为47.8%(95%,置信区间:26.8%~69.4%);其中,完全缓解(CR)率为17.4%,部分缓解(PR)率为30.4%,疾病稳定(SD)率为43.5%。此外,8.7%的患者经历了疾病进展(PD)。该人群的疾病控制率(DCR)为91.3%(95%,置信区间:72.0%~98.9%)。
4.PD-1/HER2双抗:IBI-315(消失)
IBI-315是全球首个抗PD-1/HER2双特异性抗体,由信达生物制药与韩美制药共同研发,并由信达生物制药负责在中国进行临床开发。IBI-315对T细胞PD-1的阻断作用也抑制PD-1和PD-L1之间的相互作用。IBI315的PD-1阻断功能增强了T细胞的活化,并在更多的肿瘤细胞中诱导焦亡,从而形成T细胞活化和肿瘤细胞焦下垂的正反馈回路。临床前研究显示IBI315还可以桥接T细胞和肿瘤细胞,促进杀伤肿瘤细胞。IBI-315最高研发阶段为临床二期。
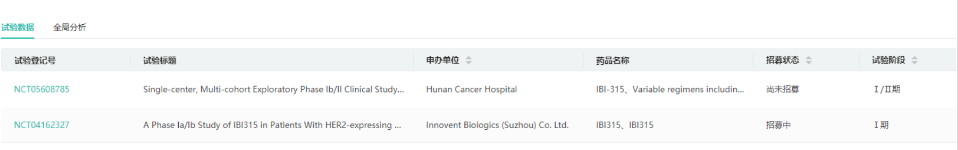
2021年CSCO年会展示IBI-315的Ia期临床研究显示,标准治疗失败的27名表达Her2晚期实体瘤患者分别接受0.03 mg/kg QW(每周)至15 mg/kgQ3W(每3周)的7个剂量水平。结果显示未达到剂量限制毒性和最大耐受剂量。共有15名接受预测有效剂量(≥1 mg/kg)的患者接受至少一次肿瘤评估,ORR为20%。根据2022年业绩报披露和官网现有在研管线,IBI-315也不见了踪影。
5.PD-L1/LAG3双抗:IBI-323
IBI323是同时靶向PD-L1及LAG-3的双特异性抗体。它在体内的优势主要可以体现在两个方面:1)同时抑制LAG-3和PD-L1介导的两个抑制性信号通路,具有比单靶点更强且更持久的T细胞活化潜力;2)通过双抗的桥接作用,可以将表达PD-L1的肿瘤细胞与表达LAG-3的T细胞拉近,从而形成稳定的TCR:MHC免疫突触,进一步激活T细胞。与联合用药相比,IBI323从作用机制角度更具优势。IBI-323目前处于临床二期,联合贝伐珠单抗和铂类化疗治疗非小细胞肺癌。
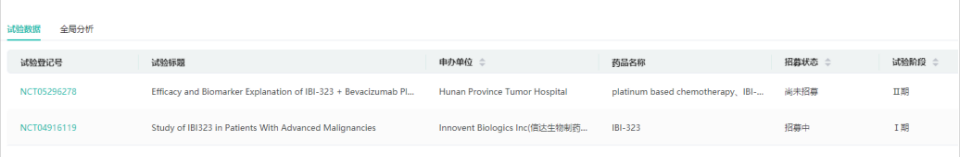
6.PD-1/TIGIT双抗:IBI-321(消失)
IBI-321是信达生物制药与礼来制药合作研发的抗PD-1/TIGIT双特异性抗体,并由信达生物制药负责在中国开发。临床前的各项研究结果均显示,IBI321保留了PD-1抑制剂的药效活性,并同时抑制TIGIT的信号,协同增强药效。2021年3月4日,IBI-321的临床试验申请获得NMPA受理。2021年7月26日,信达生物宣布其抗PD-1/TIGIT双特异性抗体(研发代号:IBI321)的1期临床研究完成中国首例患者给药。IBI-321最高研发阶段为临床一期,根据2022年业绩报披露和官网现有在研管线,IBI-321也不见了踪影。
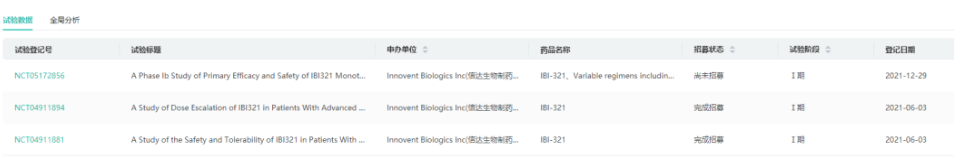
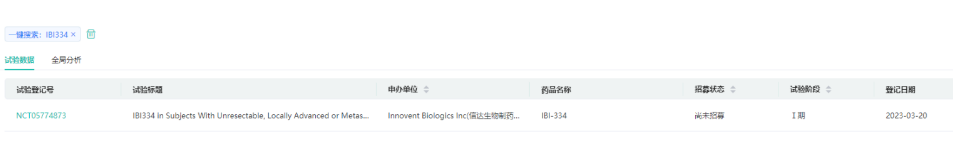
7.EGFR/B7-H3双抗:IBI-334
IBI334为信达生物开发的一款EGFR/B7H3双抗,也是全球首款EGFR/B7H3双抗。2023年3月20日,信达生物在Clinicaltrials.gov网站上注册了IBI334的一期临床。该一期临床计划入组128例晚期实体瘤患者,预计从今年7月份启动,2025年10月初步完成。2023年7月4日,信达生物IBI334的临床试验申请获得NMPA受理。2023年9月11日,中国国家药监局药品审评中心(CDE)官网公示,信达生物申报的1类新药EGFR/B7-H3双抗IBI334获得临床试验默示许可,拟用于治疗不可切除、局部晚期或转移性实体瘤患者。
结语
与单克隆抗体相比,双抗药物增加了一个特异性抗原结合位点,因而特异性更强,可较准确靶向肿瘤细胞并降低脱靶毒性,临床疗效和安全性有望更佳。同时还能有效防止耐药、降低治疗成本、提升患者用药可及性等,理论上能够达到1+1>2的治疗效果。但在实际研发中,可以发现要做到1+1>2的有效性和安全性,并非那么容易,信达生物消失的4款双抗便是最好的证明。新药研发绝非一番坦途,为所有前行者点赞。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论