
药融圈获悉:2023年9月6日,中国广州——广州华津医药科技有限公司(简称:华津医药)今天宣布,公司自主研发的用于治疗晚期实体瘤的First-in-class溶瘤细菌--桑美威克®(SGN1注射液)已经通过中国国家药品监督管理局 (NMPA)的新药临床试验申请(IND)审评,获批在中国大陆正式开展静脉给药和瘤内给药两项临床试验。

华津医药董事长赵子建博士表示:“这次华津医药开发的溶瘤细菌桑美威克®(SGN1注射液)获得国家局审评中心(CDE)的正式批准进入两项临床试验,是公司发展的一个很重要的里程碑。这一方面是CDE对华津医药的前期工作的认可,另一方面也对我们后续要开展的临床试验提出了相应的要求。华津医药将借此契机迅速布局,在一些目前缺乏有效治疗手段的恶性肿瘤适应症上,加速推动全球多中心临床试验(MRCT)。”
关于溶瘤细菌桑美威克®
溶瘤细菌桑美威克®(SGN1注射液)是全球首个(first-in-class)进入临床试验阶段的可精准靶向并快速溶解肿瘤的细菌载体基因工程生物制品。桑美威克®通过减毒沙门氏菌载体搭载特异的甲硫氨酸水解酶,剥夺肿瘤生长所需的必须氨基酸,从而杀伤肿瘤并阻止肿瘤扩散;是一种高效并针对广谱实体肿瘤的溶瘤产品。华津医药拥有桑美威克®的完整知识产权和全球权益,在全球范围的发明专利超50项,已获得授权22项。
SGN1注射液审批时间轴
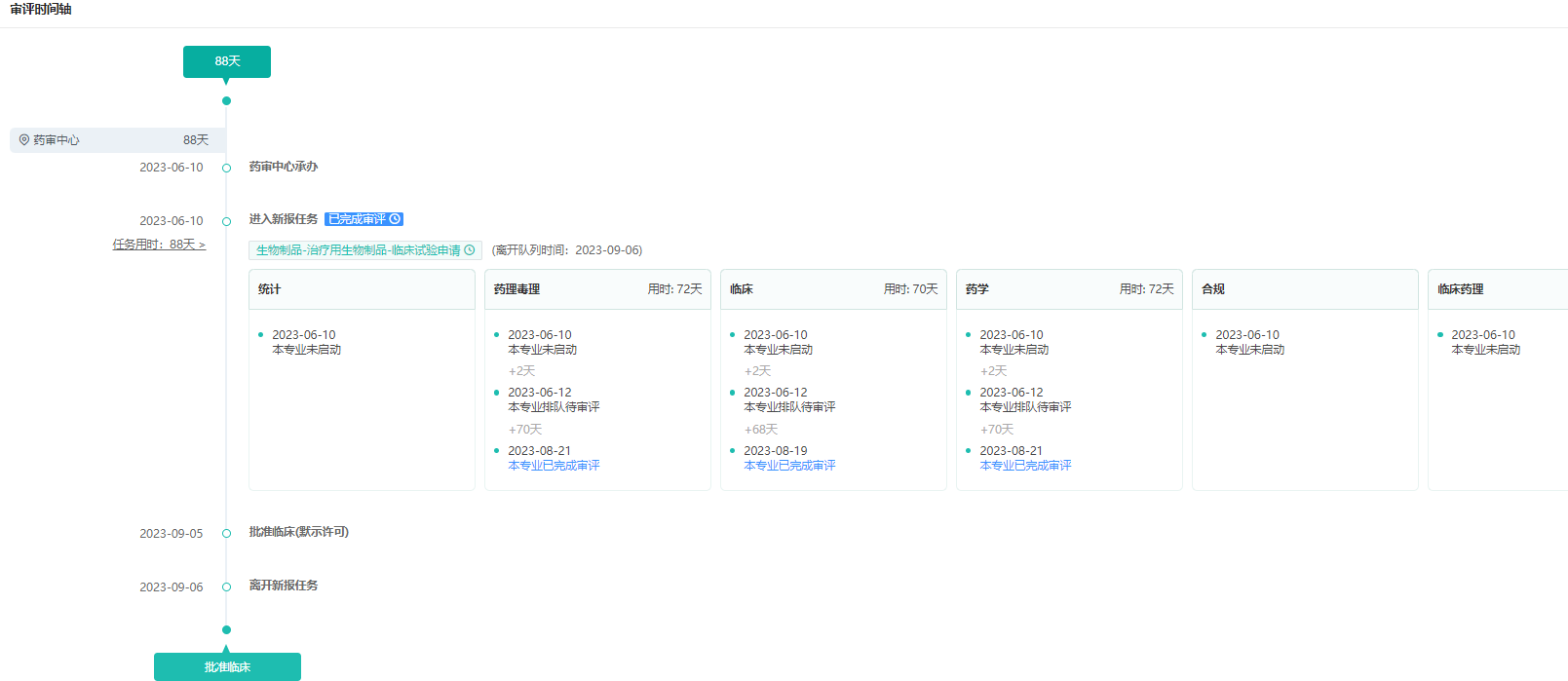
数据来源:药融云中国药品审评数据库
截至目前华津医药已经成功取得中国NMPA、美国FDA和中国台湾TFDA的新药临床试验申请(IND)许可,并正在美国和中国台湾的多家临床试验中心进行溶瘤细菌桑美威克®静脉给药和瘤内给药I/IIa期注册临床试验,试验招募肝癌、骨肉瘤、肺癌、头颈癌、前列腺癌、乳腺癌、黑色素瘤等多种晚期恶性实体瘤患者。为加速其在美国的开发和审评程序,FDA已授予溶瘤细菌桑美威克®治疗骨肉瘤、肝癌、小细胞肺癌三项孤儿药资格认定。
关于华津医药
华津医药是一家由四位国家高层次人才特聘专家共同创建,致力于创新型生物抗肿瘤药物开发,以满足全球恶性肿瘤治疗市场需求的生物制药公司。通过数十位科研人员共同努力,华津医药逐步建立了全球首个快速广谱溶瘤细菌技术平台,并完成了核心产品溶瘤细菌桑美威克®的临床前研究、CMC生产工艺开发以及符合GMP标准的规模化生产设施建设。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论