
据《药融云医药行业观察周报》统计,近日,荣昌生物的注射用泰它西普(RC18,商品名:泰爱)在中国治疗类风湿关节炎(RA)患者的3期临床研究中取得了积极结果,并向国家药品监督管理局药品审评中心递交了上市申请。
类风湿关节炎(RA)是一种慢性自身免疫性疾病,以侵蚀性关节炎为主要特征,发病初期的关节表现为关节晨僵、肿胀、疼痛等,最后可发生关节畸形并丧失关节正常功能,严重影响患者生活质量。
目前类风湿关节炎的标准治疗以抗炎类、糖皮质激素、传统免疫抑制剂及TNF-α抑制剂等药物为主,对于上述疗法无效或不耐受的患者而言,存在尚未满足的临床需求。
一. 两款首创王牌产品,领跑创新药赛道
泰它西普是荣昌生物研发的一款BLyS/APRIL双靶点融合蛋白创新药,它可以通过同时抑制BLyS和APRIL两个细胞因子的过度表达,“双管齐下”从而阻止B细胞的异常分化和成熟,进而治疗B细胞介导的系统性红斑狼疮等多种自身免疫性疾病。
泰它西普是全球首款、同类首创的注射用重组 B淋巴细胞刺激因子(BLyS)/增殖诱导配体(APRIL)双靶点的新型融合蛋白产品,由于具有新靶点、新结构、新机制的特点,其发明专利先后获得中国、美国、欧洲等国家和地区的授权,并作为具有突出临床价值的临床急需药品于2021年3月在中国获附条件批准上市。
泰它西普在研适应症进度查询(部分)

图片来源:药融云全球药物研发数据库
药融云数据库显示,泰它西普在中国获批的首个适应症,是用于治疗系统性红斑狼疮(SLE),也是近60年来国内第二个获批的系统性红斑狼疮治疗领域的新药(葛兰素史克的贝利尤单抗是第一个被批准用于治疗活动性SLE的生物制剂)。
除SLE和RA之外,泰它西普用于治疗IgA肾病、视神经脊髓炎谱系疾病、原发性干燥综合征、重症肌无力等适应症的3期临床研究正在进行中。此外,泰它西普还于2022年9月获得了美国FDA颁发的孤儿药资格认定,用于治疗全身型重症肌无力。这表明泰它西普在治疗重症肌无力方面也具有潜力。
注射用维迪西妥单抗(RC-48,商品名:爱地希)是荣昌生物的另一款王牌产品,是中国首个原创抗体偶联(ADC)药物,也是我国首个获得美国 FDA、中国药监局突破性疗法双重认定的ADC药物,其用于治疗胃癌、尿路上皮癌的新药上市申请经优先审评审批程序,并作为具有突出临床价值的临床急需药品分别于2021年6月、2021年12月在中国获附条件批准上市。
维迪西妥单抗由亲和力更高的新型人源化抗HER2抗体、可裂解连接子和微管抑制剂MMAE组成,作用机制包括抑制HER2信号通路和MMAE的细胞毒性。
维迪西妥单抗不同适应症研发进度

图片来源:药融云全球药物研发数据库
药融云数据库显示,除已获批的2项适应症(胃转移性恶性肿瘤、尿路上皮转移性恶性肿瘤)外,荣昌生物还开展了多项针对不同适应症的临床研究,包括乳腺癌(BC)、非小细胞肺癌(NSCLC)、胆道癌(BTC)、黑色素瘤、卵巢肿瘤、膀胱恶性肿瘤等。
二. 21款创新药在研,ADC占据半壁江山
荣昌生物致力于开发创新的抗体药物,研发管线包括ADC、抗体,融合蛋白等多种药物形态。药融云全球药物研发数据库显示,荣昌生物目前有21款在研新药,其中两款已有上市产品,而在研创新药中,ADC药物占据半壁江山,其次双抗的布局数量紧随ADC之后。
目前,荣昌生物有8款新药已处于临床开发阶段,其中进度最快的是RC-28(VEGF/FGF融合蛋白),处于III期临床阶段;此外还包括处于Ⅰ期临床研发阶段的RC-148(新型双特异性抗体)、RC-198(Fc融合蛋白)、RC-98(PD-L1单抗);处于II期临床的RC-108(MET-ADC)、RC-118(CLDM18.2-ADC)、RC-88(间皮素-ADC),TCN-032(单抗)。
荣昌生物研发管线治疗领域布局
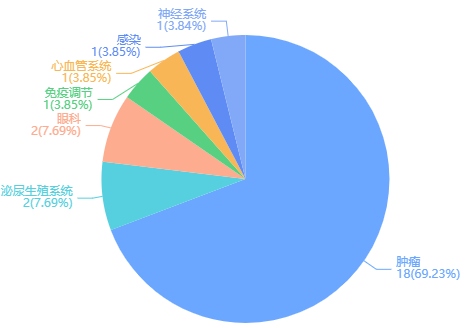
图片来源:药融云全球药物研发数据库
RC28是一款血管内皮生长因子(VEGF)/成纤维细胞生长因子(FGF)双靶点的创新融合蛋白产品,相比单靶点抑制剂有望更有效地抑制多种眼科疾病有关的眼底血管新生。
RC148是首款获批临床的双抗,拟适应症是针对多种实体瘤,标志着其研发进入“双抗”时代。荣昌生物迄今已布局5款双抗,除RC148外,还布局了聚焦肿瘤领域的RC138、RC158,以及针对眼科疾病的RC218、RC228,均处于临床试验申报准备阶段。
<END>
想要获取《药融云医药行业观察周报》完整报告内容,请关注“药融云”公众号,后台回复“报告”关键词进行领取;或者前往药融云“药融文库”网站【原创报告】栏目进行全文下载。









































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论