
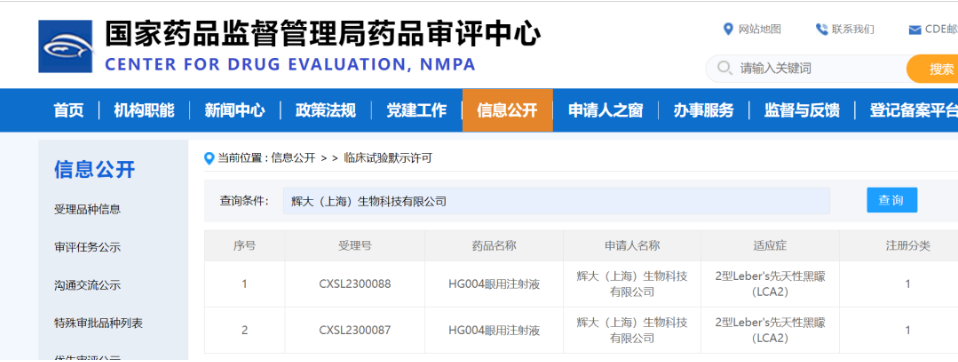
8月7日,专注于基因编辑技术和基因治疗药物开发、处于临床阶段的全球性生物技术公司——辉大(上海)生物科技有限公司(简称“辉大基因”)宣布,其自主研发的新型眼科基因治疗药物HG004获得了美国食品药品监督管理局(FDA)授予儿科罕见病资格认定(Rare Pediatric Disease Designation, RPDD),用于治疗由RPE65突变引起的遗传性视网膜疾病。
FDA授予RPDD以鼓励开发影响在美国人数少于20万,年龄在18岁或以下的儿童,严重或危及生命的疾病的新疗法。RPDD计划允许获得批准的发起人有资格获得优先审查券(PRV),该凭证可被用于任何后续产品上市申请时获得6个月的加速优先审查,或者可以出售或转让。对于一家即将推出价值10亿美元药物的大公司来说,监管审查加快6个月可能具有巨大的经济价值。PRV的历史交易价格基本上超过1亿美元(最高价格为3.5亿美元)。最近,Sarepta Therapeutics以1.02亿美元的价格出售了一张PRV。
辉大基因联合创始人兼首席执行官陆英明博士表示,“美国FDA授予的儿科罕见病资格认定凸显了辉大基因HG004解决RPE65-IRDs的重大未满足医疗需求。此外,今年3月HG004也获得FDA授予的孤儿药资格认定(ODD),将享受一定的积极政策支持,包括但不限于临床试验费用的税收减免、免除NDA/BLA申请费用、快速审批绿色通道以及上市后享有7年的美国市场独占权等。我们正在加速推动HG004的临床开发进程,为患有RPE65突变相关的遗传性视网膜疾病的患者提供安全、长期和高质量的治疗选择,更快实现辉大惠及全球患者的美好愿景。”
关于RPE65突变相关的遗传性视网膜疾病
遗传性视网膜营养不良(IRDs)是一类由基因突变引起罕见致盲性疾病,已报道致病基因超过250个。其中,RPE65基因突变可能会导致Leber先天性黑蒙(LCA)、严重的早发性儿童视网膜营养不良(SECORD)、早发性严重视网膜营养不良(EOSRD)或视网膜色素变性(RP),即这些疾病都被认为是RPE65基因突变相关视网膜病变,代表同一疾病的表型连续体。RPE65基因突变相关视网膜病变通常发病于出生至5岁之间,主要临床表征包括夜盲(凝视伴严重夜盲症和眼球震颤)、进行性视野缺失和中心视力丧失。符合世界卫生组织(WHO)失明诊断标准(双等位基因RPE65突变)的患者比例随年龄增长而增加,40岁后达到100%。RPE65基因突变相关视网膜病变引起的严重和早期视力丧失,也可能会造成语言、社交和行为等其他功能的发育延迟。
关于辉大基因
辉大(上海)生物科技有限公司(下称“辉大基因”)成立于2018年,总部位于中国上海,并在美国新泽西设有办公室,是一家全球性的临床阶段生物技术公司,专注于设计和开发基于CRISPR技术的基因治疗药物,旗下员工近200人,其中研发团队占85%以上。自成立以来,辉大基因已完成来自中国专业医疗投资机构以及知名产业基金的四轮融资,并与多家国内顶级科研机构、医院达成深度合作。
辉大基因致力于通过各项在研药物管线满足全球患者的切实需求,长期目标是利用基因编辑技术治疗遗传病以及威胁人类健康的慢性疾病。研发管线涵盖眼科、听力、肌肉、中枢神经等多个领域,拥有多项全球领先水平的技术平台,涵盖从药物靶点筛选、药物优化、高效动物模型构建,到药效、毒理分析等临床前研发,再到药物工艺开发、生产转化CMC以及药品临床及注册申报的一体化研发能力。
公司研发管线
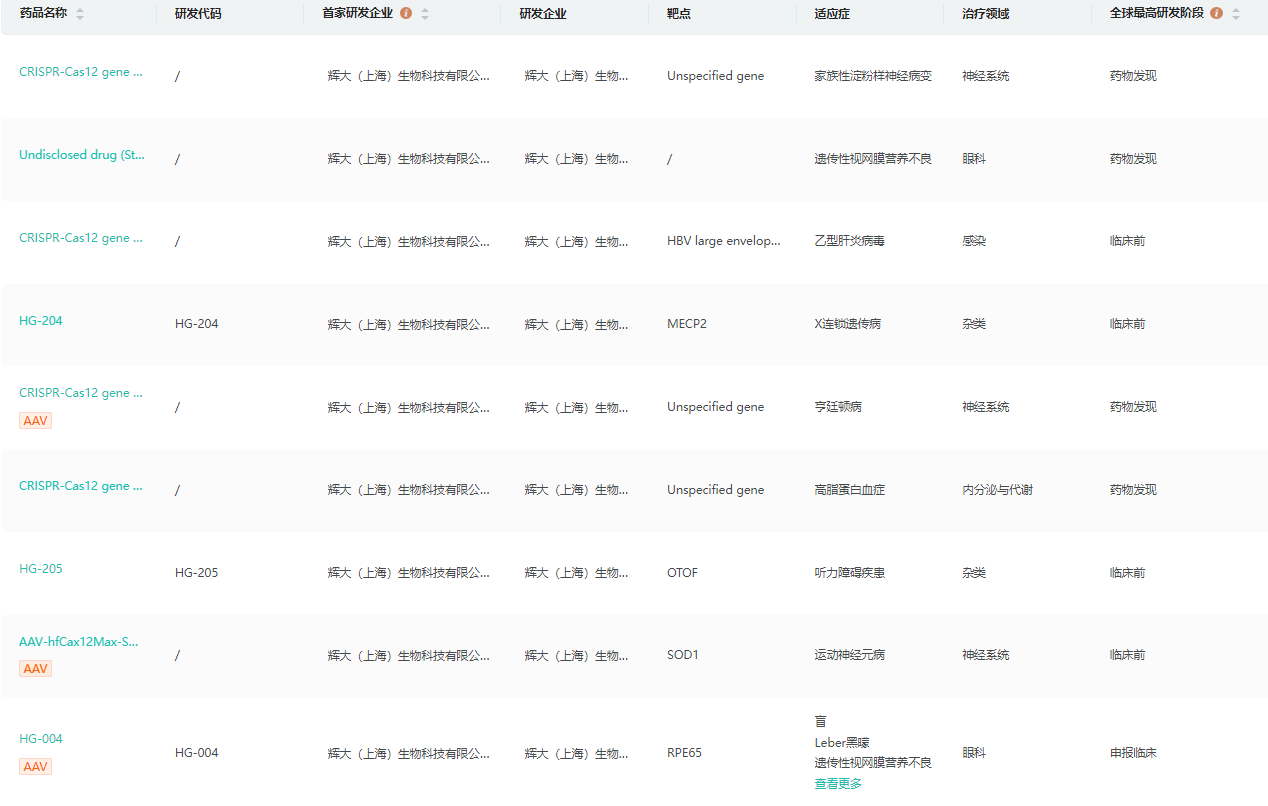

截图来源:药融云全球药物研发数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论