
在2023.07.17-2023.07.23期间,全球创新药研发又有哪些重要新进展呢?复星医药、信立泰、君实生物、百济神州.....无论您是在药企从事研发注册、商务拓展(BD)、战略研究,或是医药投资、行业分析,相信您都可以借助《药融云医药行业观察周报》快速、高效地获取最核心的新药情报信息。
1. 复星医药MEK1/2抑制剂新适应症拟纳入突破性治疗品种
近日,复星医药MEK1/2抑制剂FCN-159片拟纳入突破性治疗品种,拟定适应症为:无法手术或术后残留/复发的NF1相关的丛状神经纤维瘤成人患者。药融云数据库显示,在今年4月,FCN-159针对组织细胞肿瘤的适应症已被CDE正式纳入突破性治疗品种。
FCN-159被纳入突破性治疗品种

图片来源:药融云中国药品审评数据库
1型神经纤维瘤病(NF1)是一种常染色体显性遗传病,其RAS-丝裂原活化蛋白激酶(RAS-MAPK)信号通路增强,导致肿瘤沿神经生长。20%~50%的1型神经纤维瘤病表现为丛状神经纤维瘤(PN),并可能导致疼痛、功能损害、毁容和恶性转化等并发症。
FCN-159片是复星医药研发的创新型小分子化学药物,拟主要用于晚期实体瘤、I型神经纤维瘤、组织细胞肿瘤、动静脉畸形等的治疗。它是一款MEK1/2选择性抑制剂,可以抑制RAS通路异常引起的肿瘤增殖。
目前,手术是这类肿瘤的主要治疗手段,但疗效受限,而对于成人患者来说,还没有药物获批可用。药融云数据库显示,截至目前,全球共5款MEK抑制剂获批上市,分别为阿斯利康/默沙东的Selumetinib sulfate(司美替尼)、辉瑞/Pierre Fabre/小野制药的Binimetinib、罗氏/Exelixis的Cobimetinib、Japan Tobacco/诺华的Trametinib(曲美替尼)、泽璟生物的甲苯磺酸多纳非尼。
全球获批上市的MEK抑制剂

图片来源:药融云全球药物研发数据库
其中,在国内获批的MEK抑制剂有3款。曲美替尼于2019年12月在国内上市,国产创新药甲苯磺酸多纳非尼片于2021年6月在国内上市,司美替尼于2023年5月在国内获批上市。
此外,国内布局MEK抑制剂的药企有科州制药、恒瑞医药、复星医药、正大天晴、基石药业等。其中科州制药的妥拉美替尼已于今年1月在国内申报上市,复星医药旗下复创医药的FCN-159处于III期临床阶段,恒瑞医药的SHR7390处于II期临床阶段。
2. 信立泰口服小分子免疫抑制剂在美国获批临床
近日,信立泰自主研发的口服小分子免疫抑制剂SAL0119片获美国FDA批准,同意开展临床试验,拟开发适应症包括类风湿关节炎、强直性脊柱炎、银屑病关节炎。
强直性脊柱炎和类风湿关节炎均属于自身免疫疾病,发病原因尚不完全明确,且暂时无法治愈。这类疾病具有病程长、易反复、大部分患者需要终身治疗等特点,严重影响患者的身心健康及生活质量。
信立泰全球新闻资讯查询

图片来源:药融云新闻资讯数据库
银屑病关节炎是一种全身性炎症性疾病,症状表现在身体多个部位。银屑病关节炎患者的免疫系统产生炎症,可导致与银屑病相关的皮肤病变、关节疼痛、疲劳和僵硬。
JAK-STAT通路与类风湿关节炎等自身免疫疾病的发生息息相关,因此JAK激酶家族成为治疗这些疾病的重要靶点。
SAL0119是信立泰开发的一款口服小分子免疫抑制剂,具有不同于JAK类的作用机制和广谱的细胞因子抑制作用。在临床前研究中,该药已体现出良好的有效性和安全性。此前,该药已经在中国获得临床试验默示许可,目前正在中国开展1期临床试验。
在7月,信立泰的1类新药沙库巴曲阿利沙坦钙片(S-086)递交上市申请并获得受理。沙库巴曲阿利沙坦钙片是一款血管紧张素II受体-脑啡肽酶双重抑制剂(ARNi),目标适应症为高血压和慢性心力衰竭。
目前国内用于高血压的ARNi类药物仅诺华的沙库巴曲缬沙坦钠片(商品名:诺欣妥),药融云全国医院销售(全终端)数据库显示,2022年诺欣妥在国内医院市场的销售规模达到21.41亿元。
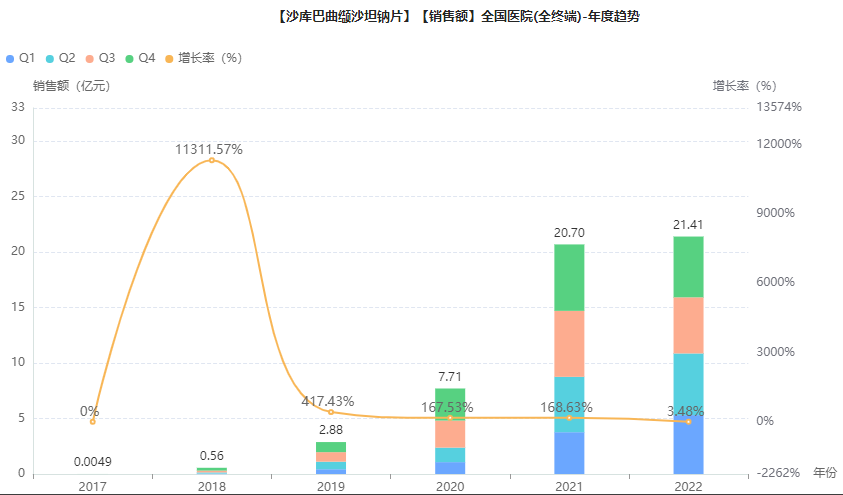
图片来源:药融云全国医院销售(全终端)数据库
此外,国内已有石药集团、正大天晴、齐鲁制药、科伦药业、华润双鹤、昂利康等20多家企业提交沙库巴曲缬沙坦仿制药上市申请。等到信立泰的S086获批上市,或将有望改写国内市场竞争格局。
3. 微芯生物「西达本胺」新适应症申报上市
微芯生物研发的亚型选择性组蛋白去乙酰化酶(HDAC)口服抑制剂西达本胺联合R-CHOP(利妥昔单抗、环磷酰胺、阿霉素、长春新碱和强的松)用于既往未经治疗的MYC和BCL2表达阳性的弥漫大B细胞淋巴瘤(DLBCL)患者的上市申请获得中国国家药监局(NMPA)受理。
DLBCL是常见的一类淋巴瘤,海内外临床诊疗指南和共识均推荐R-CHOP方案作为DLBCL的标准一线治疗方案,但在总体人群中仍有约1/3或以上的患者对一线R-CHOP治疗无效或早期复发。同时,在DLBCL中约有30%患者存在着MYC/BCL2同时过度表达(简称“双表达”淋巴瘤),其经R-CHOP治疗的疗效和预后显著低于非双表达患者。
西达本胺(chidamide,商品名:爱谱沙/Epidaza)是微芯生物发现的一款通过口服的亚型选择性组蛋白去乙酰化酶(HDAC)抑制剂,于2014年12月在国内获批上市,上市后成为微芯生物业绩增长的主力。西达本胺单药及联合其他抗肿瘤药物针对弥漫性大 B 细胞淋巴瘤、非小细胞肺癌及 HIV 的临床研究在多个国家和地区开展。随着大适应症的拓展,未来有望快速放量成为20亿级重磅产品。
西达本胺全球临床试验查询
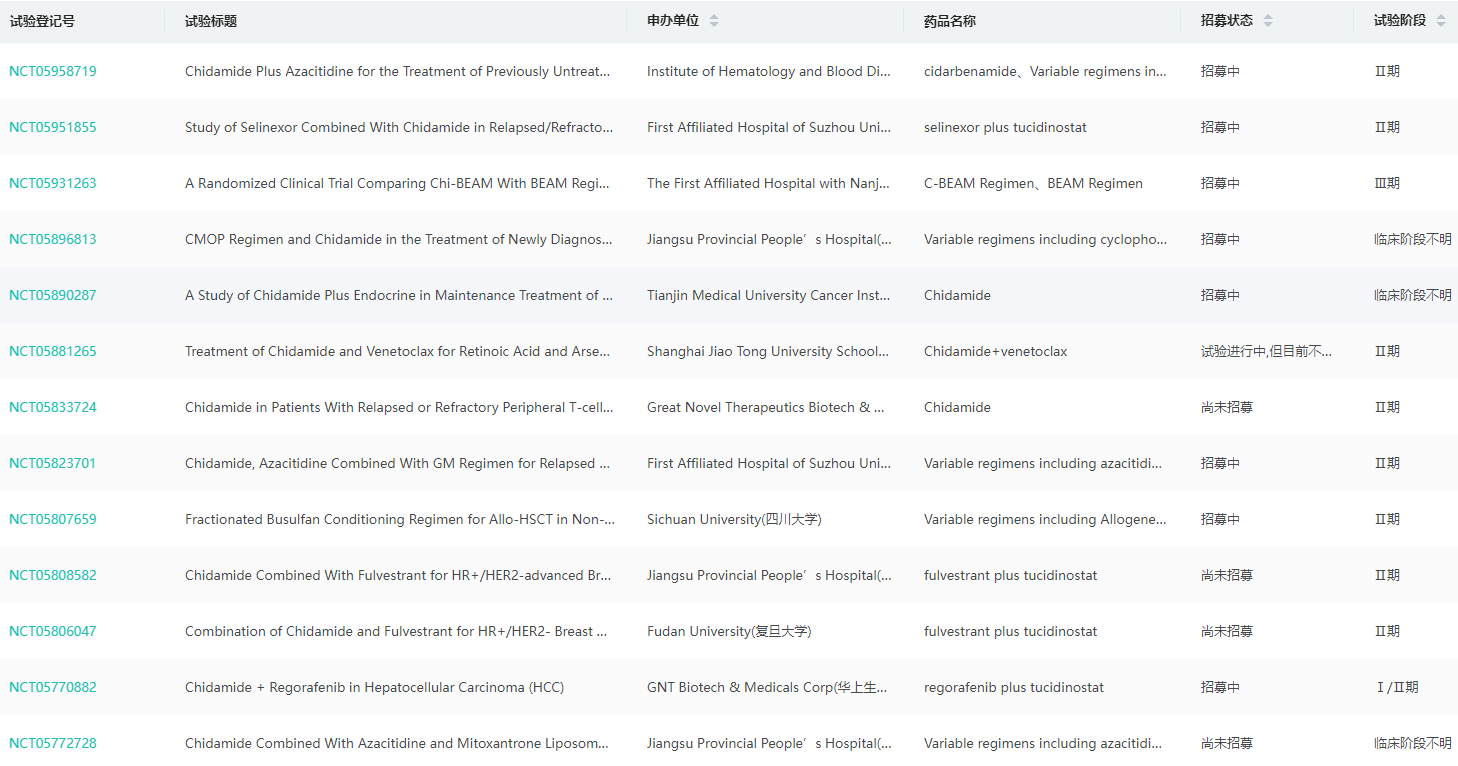
图片来源:药融云全球临床试验数据库
4. 君实生物抗PD-1单抗在中国递交第10项上市申请
君实生物的抗PD-1单抗药物特瑞普利单抗的新适应症上市申请被受理,联合依托泊苷和铂类用于广泛期小细胞肺癌一线治疗。
特瑞普利单抗注射液是以PD-1为靶点的单抗药物,至今已在全球(包括中国、美国、东南亚及欧洲等地)开展了覆盖数十项由公司发起的临床研究,涵盖肺癌、鼻咽癌、食管癌、胃癌、膀胱癌、乳腺癌、肝癌、肾癌及皮肤癌等瘤种。
药融云数据库显示,截至目前,特瑞普利单抗的6项适应症已于中国获批,其中3项适应症已被纳入中国国家医保目录(2022年版)。今年以来,该产品针对非小细胞肺癌(NSCLC)、三阴性乳腺癌以及肾细胞癌一线治疗的新适应症上市申请又先后获得CDE受理。
特瑞普利单抗适应症查询
图片来源:图片来源:药融云全球药物研发数据库
5. 百济神州抗PD-1抗体有望在欧盟获批上市
7月21日,百济神州抗PD-1单抗替雷利珠单抗的上市许可,获得欧洲药品管理局(EMA)人用药品委员会(CHMP)的积极意见,建议批准替雷利珠单抗单药用于治疗既往接受过含铂化疗的不可切除、局部晚期或转移性食管鳞状细胞癌(ESCC)成人患者。
替雷利珠单抗注射液是一款人源化IgG4抗PD-1单克隆抗体,设计目的旨在最大限度地减少与巨噬细胞中的Fcγ受体结合,帮助人体免疫细胞识别并杀伤肿瘤细胞。临床前数据表明,巨噬细胞中的Fcγ受体结合之后会激活抗体依赖细胞介导杀伤T细胞,从而降低了PD-1抗体的抗肿瘤活性。
替雷利珠单抗全球研发详情查询

图片来源:药融云全球药物研发数据库
药融云全球药物研发数据库显示,替雷利珠单抗于2019年在华获批上市,截止目前,已在华已批准了11项适应症,其中9项纳入医保,成为了纳入医保适应症最多的PD-1。
想要获取《药融云医药行业观察周报》完整报告内容,请关注“药融云”公众号,后台回复“报告”关键词进行领取;或者前往药融云“药融文库”网站【原创报告】栏目进行全文下载。








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论