
据药融云数据库,2022年,BTK抑制剂泽布替尼全球销售额达38.29亿元,约占百济神州产品总销售收入的45%(84.80亿元),是毫无疑问的当家产品。泽布替尼所处的血液肿瘤也是百济神州的重点布局领域之一。目前,公司管线中有3款自研产品进入临床阶段,除了泽布替尼,还有Bcl-2抑制剂sonrotoclax(BGB-11417),以及BTK-CDAK产品BGB-16673。
BGB-11417药物研发信息
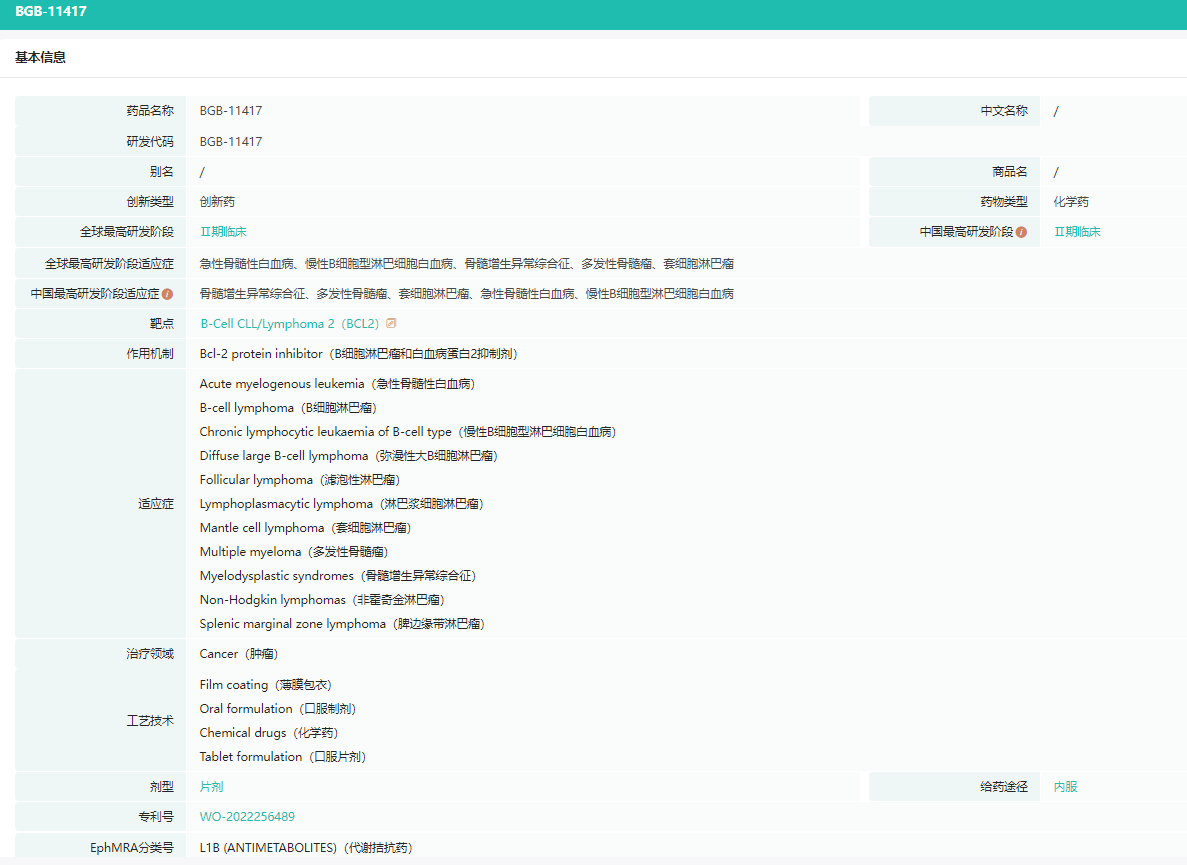
图片来源:药融云全球药物研发数据库
BGB-16673
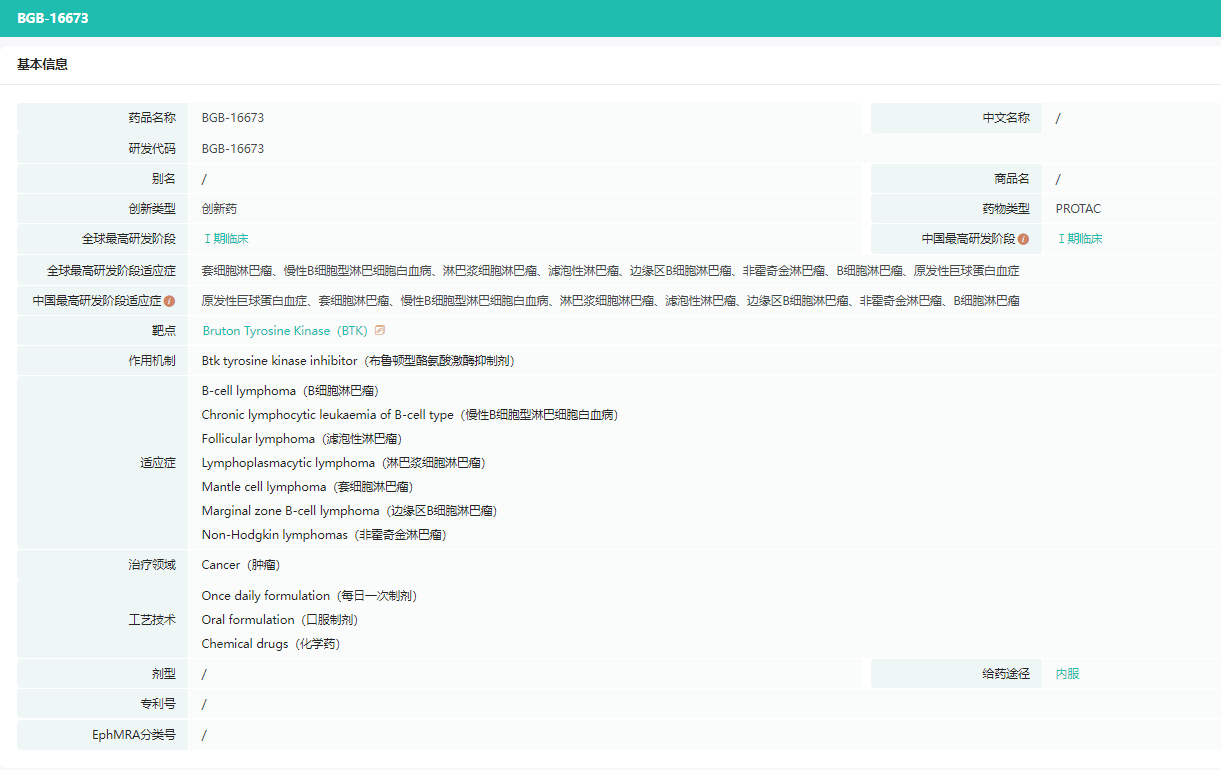
图片来源:药融云全球药物研发数据库
不同的靶点方向有不同的发展路径,有各自主攻的适应症方向,也有协同作业。在近日举办的百济神州血液肿瘤高峰论坛上,我们从管线最新进展和开发策略的解读,进一步了解百济神州血液肿瘤管线在形成怎样的矩阵。
当家产品泽布替尼的后劲
慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)这一适应症可以说是泽布替尼开发中非常重要的里程碑。
2020年,泽布替尼获中国食药监总局(NMPA )批准治疗复发或难治性CLL/SLL;去年10月,头对头ALPINE试验公布结果,证实泽布替尼优于伊布替尼;今年1月,获FDA批准用于复发或难治性CLL/SLL。
CLL/SLL本身有较大的市场需求,也是BTK抑制剂最大的细分市场,进入这个市场明显带动泽布替尼的销售。据公司发布的第一季度财报,泽布替尼在美国第一季度销售额总计9.50亿元,上年同期美国市场销售额总计4.31亿元,120%的增长主要来自CLL/SLL适应症上的推动。
实际上针对CLL/SLL适应症,泽布替尼趁热打铁,有一系列布局和新的动向,主要体现在从复发难治向一线新诊断的进军。今年5月,NMPA批准泽布替尼四项注册申请,包括两项新增适应症的上市许可申请,其中之一是新诊断的成人CLL/SLL,一项是新诊断成人华氏巨球蛋白血症(WM)。还有两项附条件批准转为常规批准的补充申请,包括既往至少接受过一种治疗的成人CLL/SLL和WM。
联合治疗也是一个发展重点。据百济神州副总裁、中国血液肿瘤临床开发负责人郭海宜介绍,B细胞瘤里面,公司以已经证实了同类最优的BTK抑制剂泽布替尼作为一个基石,围绕它可以进行很多不同的联合探索,不同的作用机制进行联合,1+1大于2的方向。
在这些联合的探索中,进展较快的包括联合奥妥珠单抗用于治疗既往至少经过二线治疗后复发或难治性滤泡性淋巴瘤(FL)成人患者,今年7月,该联合方案在美国递交了上市许可申请(sNDA),是在美国的第5项新适应症;另有与sonrotoclax联合治疗新发的CLL/SLL的全球3期多中心临床即将启动,BTK与Bcl-2产品联合是被业界认为比较有潜力的方向,该机理联合方面已有获批方案,2022年Venetoclax联合伊布替尼一线治疗CLL被欧盟批准。
最优到首创的拓展
对于百济神州而言,Bcl-2抑制剂sonrotoclax代表的则是另一个“盘子”。
郭海宜表示,公司现阶段针对血液肿瘤有两盘不同适应症的大布局,其中之一是以Bcl-2抑制剂为核心的研发领域,围绕此,还有TIM3、CD70和LAC-3相关产品,适应症主要在白血病、骨质增生异常综合症、多发性骨髓瘤等方向。百济神州针对sonrotoclax的开发策略与泽布替尼类似,寻求的是“同类最佳”潜力。
Bcl-2抑制剂领域,第一个获批也是目前唯一获批的产品是Venetoclax,这必然是sonrotoclax重要的参照系。据郭海宜介绍,公司通过对sonrotoclax进行结构调整,使它具有更好的效能,sonrotoclax对野生型的效价是Venetoclax的大约14倍,对于可能产生耐药的Bcl-2突变患者效价是Venetoclax的57倍,同时sonrotoclax有很高的选择性。
sonrotoclax的临床研究数据已经陆续公布出来。最近举办的百济神州研发日上,较新的数据显示,sonrotoclax联用泽布替尼在初治的CLL/SLL中,客观缓解率(ORR)达到了100%,在至少3次基线评估的患者中 (n=37) ,完全缓解率(CR)达到了35%。郭海宜表示,更值得欣喜的是,BTK抑制剂无论是共价还是非共价的,因为作用机制的问题,不太能达到微小病灶的全部清除,Bcl-2抑制剂这方面有更好的表现,而sonrotoclax相比于第一代的Venetoclax,微小残留病灶清除更高,Venetoclax达到微小病灶残余清除的中位时间为13~18个月,sonrotoclax的中位时间在6~7个月。目前看来,相比于单药,sonrotoclax在与泽布替尼联合中有更好的表现。
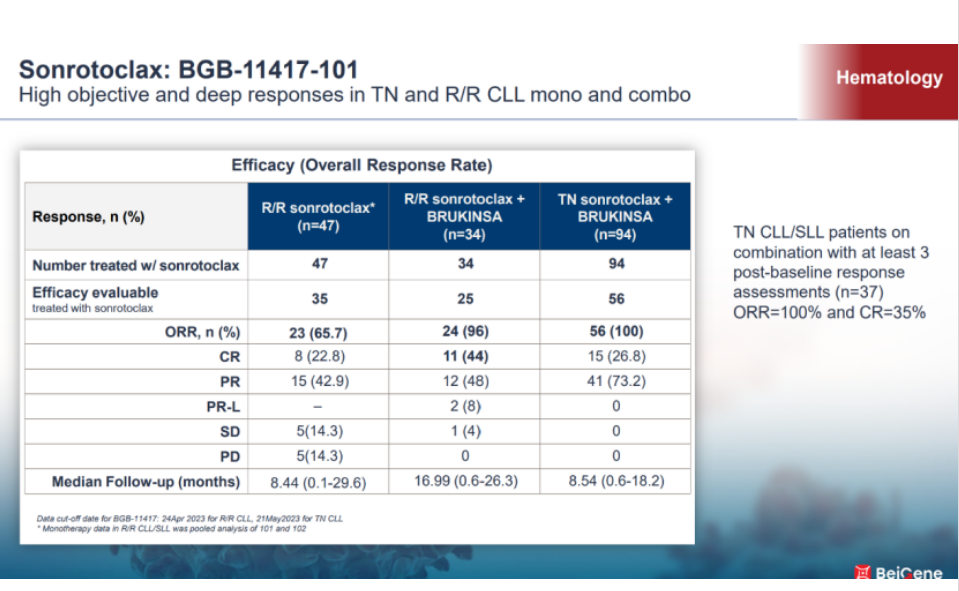
“这些数据信号都让我们似曾相识,就像最初开发泽布替尼时所观察到的那样。尽管目前sonrotoclax还处于临床的早期,但临床数据已经给到我们很大信心。”在公司血液肿瘤管线中,另一款核心产品BGB-16673的开发策略与上述的泽布替尼和sonrotoclax有所不同。
BGB-16673是一款蛋白降解产品(PROTAC),是百济神州CDAC平台的第一款产品。针对BTK靶点的PROTAC产品,主要解决的是BTK抑制剂的耐药问题,目前还没有上市的。2022年1月,BGB-16673获NMPA批准进入临床,是国内第二款,全球第三款进入临床的BTK-PROTAC。因此,BGB-16673的开发策略追求的是同类首创。
对于处在更为早期阶段的BGB-16673,郭海宜进一步介绍,BGB-16673在最低爬坡剂量时,已经可以看到BTK蛋白降到了不可测量的水平,而且可以相当长时间去维持。这意味着其未来在临床上有很大的潜力达到很好的治疗效果。目前这个项目在中国和全球非常快地推进中。
由于同样作用于BTK靶点,现场有人提问,是否会开展BGB-16673与泽布替尼的头对头研究。郭海宜回应:目前不会开展与泽布替尼头对头研究,针对BGB-16673的开发主要还是解决现在临床上暂时未解决的问题,比如泽布替尼效果很好,但是长期治疗的还是会出现疾病进展、复发,主要的适应症CLL/SLL现在为止还是不可治愈的疾病,BGB-16673会在这块做一定的探索。
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论