5月11日,ImmunityBio表示,该公司IL-15超级激动剂Anktiva(N-803)与卡介苗联合治疗膀胱癌的上市申请被美国FDA拒绝批准。
受此消息影响,ImmunityBio的股价在周四大跌55.14%至2.79美元。

据了解,ImmunityBio在本周二收到了FDA的完整回复函,此次拒批主要是由于FDA在对其第三方合同制造商进行许可前检查时发现了缺陷。
FDA还就如何解决问题给出了建议,指出了ImmunityBio必须解决的制造问题,还要求其在重新提交的文件中更新Anktiva组合的某些安全性和有效性数据。
Anktiva是一种IL-15超级激动剂,由IL-15突变体(IL-15N72D)与IL-15受体α/IgG1 Fc融合蛋白结合而成,通过T细胞受体的β链结合直接特异性刺激CD8+T细胞和NK细胞来产生抗癌活性,同时避免T-reg刺激。
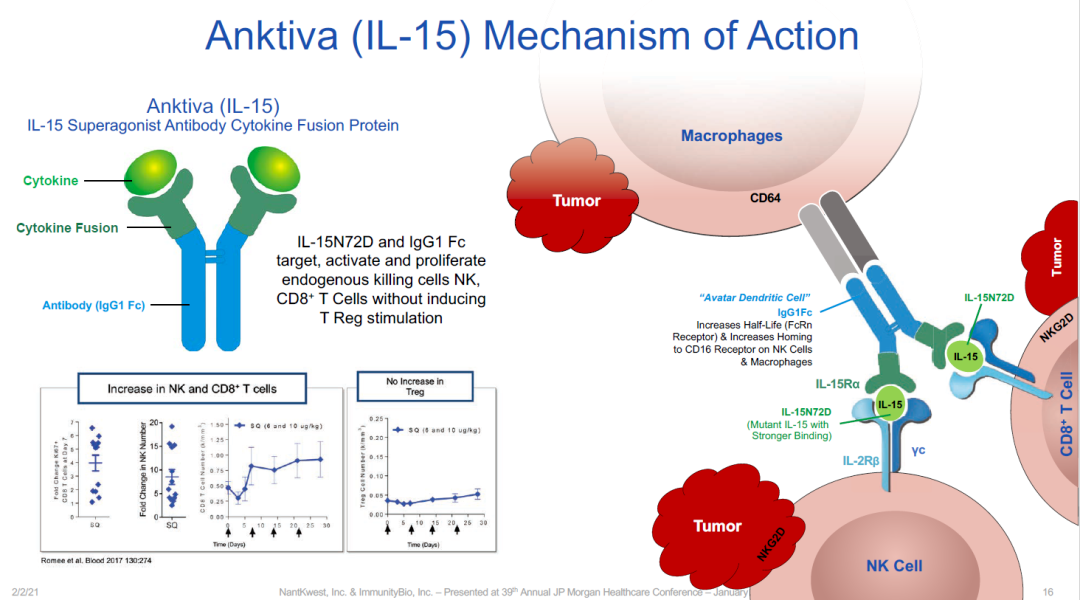
在2022年7月,ImmunityBio宣布Anktiva(nogapendekin alfa)的上市申请获得了FDA的受理,与卡介苗联用治疗对卡介苗不响应的非肌层浸润性膀胱癌(NMIBC)原位癌(CIS)患者。
Anktiva研发现状(部分,完整内容请登录“药融云数据库www.pharnexcloud.com/?mh”查看)
截图来源:药融云全球药物研发数据库
该IL-15超级激动剂上市申请的提交是基于一项II/III期临床试验QUILT 3.032,结果显示,接受Anktiva治疗的CIS患者,完全缓解率达到71%(59/83),2年总生存率为99%,中位持续响应时间为24.1个月。
本次Anktiva上市申请被FDA拒批,主要还是由于生产制造方面的缺陷所导致的,虽然要求对其安全性和有效性数据进行更新,但对其药效并没有太多问题,后续解决生产制造问题就可以重新提交上市申请。
据药融云数据库查询,目前在全球范围内,IL-15靶点研发难度大,截止目前已有14个药品无后续报道、5个药品停止研究,尚无药品获批上市。ImmunityBio是进度最快的企业,其次就是有24个药品处在临床2期、16个药品处在临床1期。按当前形式来看,不出意外的话,Anktiva将会成为全球首款获批上市的IL-15超级激动剂,意义重大。
IL-15靶点全球研发情况
截图来源:药融云全球药物研发数据库
信息参考:
[1] 药融云数据库
[2] https://www.biospace.com
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论