
近日国内多地优化疫情防控措施,加强新冠疫苗接种。针对变异毒株尤其是奥密克戎的单价/多价苗,预计国内将加快审评审批。近日,随着神州细胞的重组新冠病毒2价(Alpha/Beta 变异株)S三聚体蛋白疫苗经国家有关部门论证被纳入紧急使用后,预计国内首个mRNA新冠疫苗或将迎来上市,且有望花落石药集团(01093.HK)。
石药集团(01093.HK):mRNA新冠疫苗望近期获批。公司三季报显示,mRNA新冠疫苗SYS6006的1、2期临床试验及序贯加强免疫的临床研究报告均已上交CDE,且公司近期应疫苗专班要求提交了紧急使用报告。
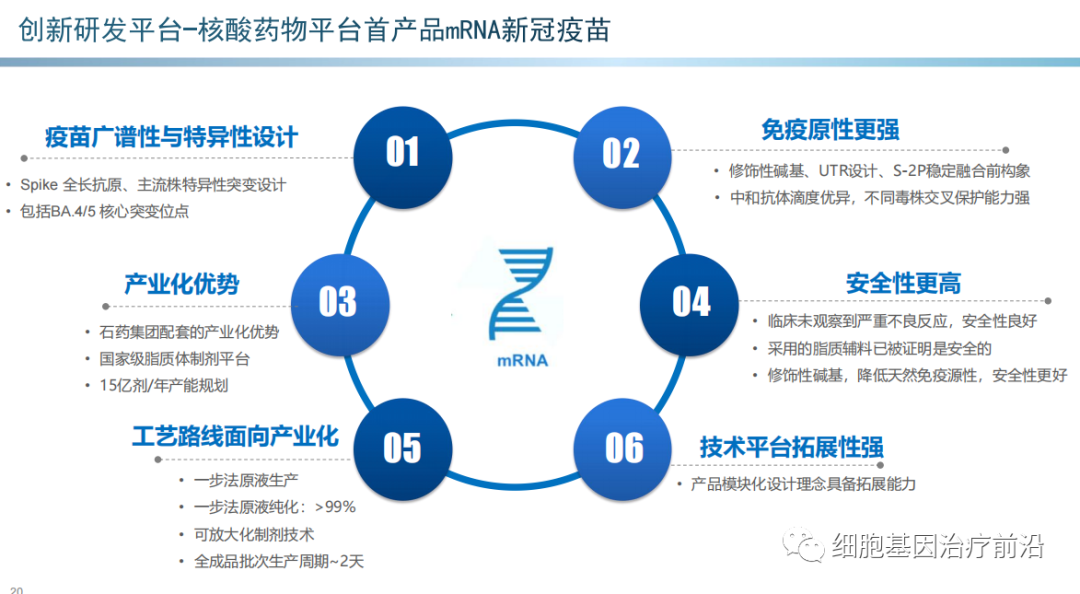
目前公司跟监管部门沟通顺利,在CDE有阶段性评审结果之后将以论文或会议形式陆续发布临床数据。公司疫苗已建成5亿剂/年产能,年底将达到15亿剂/年,核心原材料、辅料实现内部生产。
此外,复星医药/BioNTech的mRNA新冠疫苗目前国内正处审批阶段。公司三季报显示,2022年,复必泰(mRNA新冠疫苗)持续推进在港澳台地区的接种及新剂型注册。其中,幼儿剂型已于2022年8月获批于中国台湾地区开展6个月到4岁幼儿接种(儿童剂型已于2022年5月获批)、儿童及幼儿剂型已于 2022年9月获认可在中国香港作紧急使用、幼儿剂型已于2022年10月获中国澳门的进口疫苗之预先许可(儿童剂型已于2022年4月获批),针对奥密克戎BA.4/BA.5的二价疫苗于2022年10月获批中国台湾地区紧急使用、并已于港澳地区分别递交了紧急使用/特別进口申请。
沃森生物的mRNA新冠疫苗目前国内处于III期。2022年9月30日公司新型冠状病毒mRNA疫苗获得印度尼西亚紧急使用授权(“EUA”),系我国自主研发的首个获批海外上市的新冠mRNA疫苗,用于18岁及以上人群基础免疫或加强免疫。公司积极布局mRNA技术平台:和蓝鹊生物合作的新冠变异株mRNA疫苗正在滚动提交临床申请资料;和艾博生物合作的带状疱疹mRNA疫苗、和蓝鹊生物合作的RSV mRNA疫苗和流感mRNA疫苗、和圣诺合作的通用流感siRNA药物处于临床前研究。
艾博生物:成立于2019年, 2020年1月mRNA新冠疫苗项目ARCoV立项,当年6月获得国内首个IND批文,2021年9月启动国际多中心III期临床,目前正在等待揭盲,有望于2022年底申报上市。
斯微生物:2016年在上海张江成立,由美国MD Anderson肿瘤中心博士团队归国创立;2017年7月,公司获得康奈尔大学休斯顿卫理公会医院沈海法教授发明的mRNA递送技术——脂质多聚物纳米载体技术平台(LPP/mRNA)相关专利的全球独家授权。LPP递送载体可规避LNP的专利纠纷风险,有望带来差异化疗效。mRNA新冠疫苗2021年1月获批 IND,目前处于II期临床。
根据WHO数据,截至2022年11月23日,全球在研的新冠疫苗管线175个,其中重组蛋白、mRNA等技术路线占比相对较高;从给药方式(Route of administration)看,肌肉注射型仍是主体。
药融云数据显示,目前国内mRNA新冠疫苗研发企业还有康希诺、艾博生物、艾美疫苗、石药斯微生物、瑞科生物、海昶生物、天境生物、嘉晨西海、美诺恒康、丽凡达生物、星亢原、蓝鹊生物、深圳瑞吉生物、云顶新耀、厚存纳米、深信生物、传信生物等。
参考资料:
各公司公告
药融云数据库
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论