
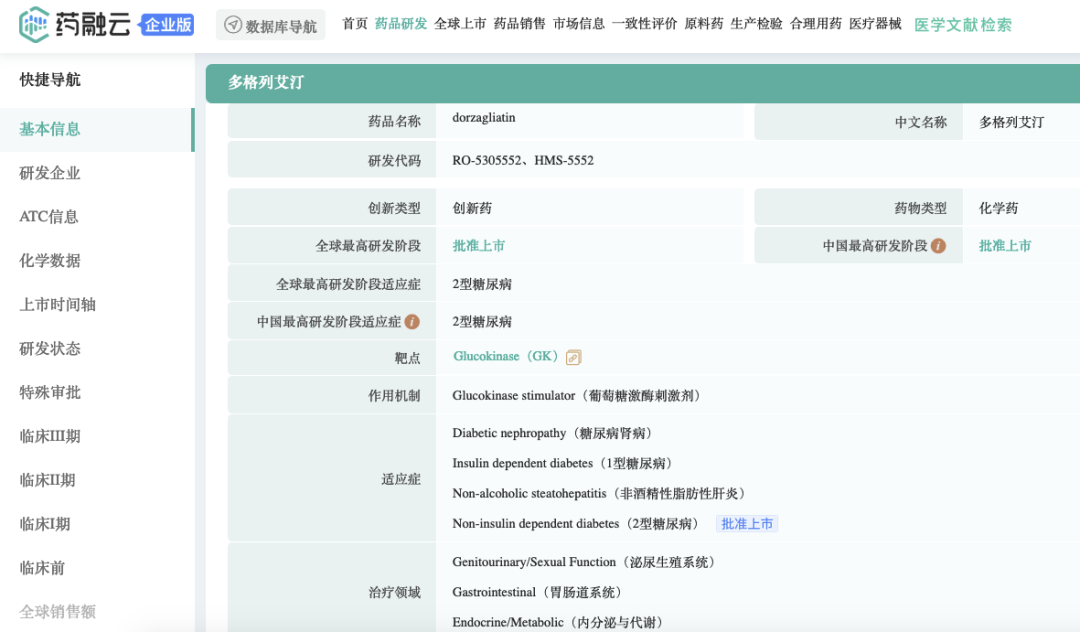
药融云数据(vip.pharnexcloud.com/?zmt-mhwz)显示:近期,中国国家药品监督管理局(NMPA)批准全球首创糖尿病新药华堂宁®(多格列艾汀片,dorzagliatin),用于单独用药,或者在单独使用盐酸二甲双胍血糖控制不佳时,与盐酸二甲双胍联合使用,配合饮食和运动改善成人2型糖尿病患者的血糖控制(《全球首个葡萄糖激酶激活剂!华领医药多格列艾汀片国内获批上市》)。
▲药融云数据:www.pharnexcloud.com/?zmt-mhwz
多格列艾汀片是拜耳与华领医药在糖尿病治疗领域达成的推广的产品合作,是全球范围内首个获批的葡萄糖激酶激活剂类(GKA)药物。多格列艾汀片以其全新的作用机制,引领“稳态降糖”的新理念。此次获批的多格列艾汀片是拥有全新机制的全球首创的口服糖尿病新药,将为中国2型糖尿病患者提供创新的治疗选择。
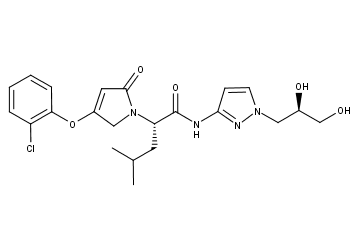
▲dorzagliatin结构式,化合物专利WO-2009127546
正常生理状态时,人体血糖水平的波动维持在3.9-5.6mmol/L这一狭窄的范围内,以确保机体的正常生理功能,这种状态称之为血糖稳态。葡萄糖激酶(GK)作为细胞内葡萄糖代谢的第一个关键酶,介导了人体的葡萄糖感知与调控,是人体自身葡萄糖维稳机制——血糖稳态自主调节中的关键,而基础研究表明,2型糖尿病(T2DM)患者普遍存在GK损伤,从而血糖稳态自主调节机制失常,人体自身血糖调控能力受损,血糖失稳态。然而,尽管目前降糖药物种类繁多,但尚无任何针对人体自身调糖能力的糖尿病治疗药物。多格列艾汀片是全球首个获批的葡萄糖激酶激活剂(GKA),直击葡萄糖代谢第一步,修复GK功能,重塑血糖稳态自主调节。依靠提升人体自身葡萄糖的处置能力,从而解决血糖失稳态这一临床问题。这是与目前所有糖尿病治疗方案完全不同的治疗逻辑,将为中国数以亿计的糖尿病患者和临床医生提供全新治疗选择和血糖管理新思路。

▲葡萄糖激酶激活剂(GKA)药物的研发 20 年
华堂宁®的此次获批是基于两项III期新药上市注册临床试验的关键里程碑——SEED研究和DAWN研究。两项III期临床研究表明,华堂宁®单药或联合二甲双胍用药有效降糖的同时低血糖风险低,并可显著改善2型糖尿病患者的β细胞功能、降低胰岛素抵抗,耐受性和安全性良好。
药融云数据显示:本款糖尿病新药价格为420元人民币一盒,每盒28片,1天2片,是常规糖尿病患者2周的用量。
关于华领医药
华领医药是一家创立于中国的创新药物研发公司,专注于未被满足的医疗需求,为全球患者开发全新疗法。华领医药汇聚全球医药行业高素质人才,融合全球创新技术,依托全球优势资源,研究开发突破性的技术和产品,引领全球糖尿病医疗创新。其核心糖尿病新药产品华堂宁®(多格列艾汀片)以葡萄糖传感器葡萄糖激酶为靶点,提升2型糖尿病患者的葡萄糖敏感性,在中国完成了播种研究(SEED)和黎明研究(DAWN)两项III期注册试验,并已正式获得中国国家药品监督管理局(NMPA)的新药上市批准。这款全球首创的葡萄糖激酶激活剂在临床研究中展示了糖尿病缓解的潜力,以帮助全球数亿糖尿病患者。

▲华领医药与罗氏制药合作条款
华领-拜耳关于糖尿病新药的合作

▲拜耳与华领医药合作条款
2020年8月,跨国医药企业拜耳与中国创新药物研发公司华领医药宣布就全新首创糖尿病新药多格列艾汀在中国建立战略合作。此项合作旨在充分发挥拜耳在中国糖尿病管理领域的深厚优势以及华领医药在糖尿病领域的研发专长,双方合力提供全新的治疗方案选择,造福中国亿万糖尿病患者。根据合作协议,华领医药作为药品上市许可持有人将负责临床研究,药品注册,药品供应及配送;拜耳作为推广服务提供方将负责该产品在中国的市场营销,推广以及医学教育活动。拜耳处方药中国合作创新中心促成了此次合作。作为全球医药领域的领导者,拜耳致力于携手外部合作伙伴,共同推动突破性创新,为患者健康带来积极转变,实现“合作创新,携手治愈”的目标。
关于拜耳
拜耳作为一家跨国企业,在生命科学领域的健康与农业方面具有核心竞争力。公司致力于通过产品和服务,帮助人们克服全球人口不断增长和老龄化带来的重大挑战,造福人类和地球繁荣发展。拜耳致力于推动可持续发展并对业务产生积极影响。同时,集团还通过科技创新和业务增长来提升盈利能力并创造价值。在全球,拜耳品牌代表着可信、可靠及优质。在2021财年,拜耳的员工人数约为100,000名,销售额为441亿欧元。不计特殊项目的研究开发投入为53亿欧元。
此文仅用于向医疗卫生专业人士提供科学信息,不代表平台立场
参考:
NMPA/CDE;
药融云数据:vip.pharnexcloud.com/?zmt-mhwz;
FDA/EMA/PMDA;
相关公司公开披露;
www.bayer.com;
https://www.huamedicine.com/;
等等。
<END>





























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)









 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论