
心血管疾病是全球的主要死亡原因,根据药融咨询《中国心血管系统药物分析报告》,近30年,全球心血管疾病(CVD)患病人数几乎翻了一番,从1990年的2.7亿例增长到2019年的5.23亿例,人口增长和老龄化是心血管疾病患病人数增长的主要驱动因素。其中,动脉粥样硬化是心脏病发作、中风和周围血管疾病的主要原因,动脉粥样硬化性心血管疾病(ASCVD)最重要的危险因素之一是高胆固醇血症,即体内LDL-C(低密度脂蛋白胆固醇)水平升高。
他汀类药物是一类降脂药物,是目前治疗高危心血管病伴高胆固醇患者的标准治疗药物,然而,相当比例的高胆固醇患者单独使用他汀类药物治疗不能将LDL-C降至理想水平。虽然目前市场上有非他汀类药物治疗方案,例如PCSK9(前蛋白转化酶枯草溶菌素9)抑制剂作为降脂治疗的新选择,但其价格昂贵且为注射制剂,限制广泛使用。因此,鉴于庞大的疾病人群,对于强效、经济和方便的低密度脂蛋白降低疗法作为他汀类药物的辅助治疗方面,依然存在着巨大的未满足需求。

药融云数据显示,NewAmsterdam Pharma(NASDAQ:NAMS,以下简称NAP)是一家总部位于荷兰纳尔登的临床阶段生物制药公司,其使命是改善代谢性疾病患者的治疗,这些疾病目前批准的疗法尚未足够成功或耐受不良。
NAP正在研究Obicetrapib,一种口服、低剂量和每日一次的CETP(胆固醇酯转运蛋白)抑制剂,作为首选的LDL-C(低密度脂蛋白胆固醇)降低疗法,用于高危心血管疾病患者的最大耐受剂量他汀类药物治疗的辅助治疗。同时,该公司认为CETP抑制有可能通过降低阿尔茨海默氏症、2型糖尿病等疾病的进展风险,从而在其他适应症中发挥作用。
👀 成功率0%的高难度靶点
CETP(胆固醇酯转运蛋白)是一种由肝脏分泌的血浆糖蛋白,介导胆固醇酯和甘油三酯在高密度脂蛋白(HDL)、极低密度脂蛋白(VLDL)和低密度脂蛋白(LDL)颗粒之间的双向转运。1980年代中期,日本首次报道了CETP(胆固醇酯转运蛋白)活性遗传缺陷及其与改善脂质成分(降低LDL-C和增加HDL-C),减少早发性动脉粥样硬化的关系。
其实针对CETP(胆固醇酯转运蛋白)抑制剂,早已有几家大药厂开展过大规模研究,CETP曾被认为是心血管领域新的重磅靶点,但是针对这一靶点,依然没有药物上市,可见其开发难度之高。
最先开启3期临床研究的CETP抑制剂是辉瑞的torcetrapib,但研究显示该药物增加了心血管事件和死亡的风险,最终不得不提前终止开发,而辉瑞已在该药物研发上斥资了8亿美元,torcetrapib成为了辉瑞研发史上最惨痛的失败之一。后来发现torcetrapib具有结构相关的脱靶效应,导致血压升高,醛固酮、类固醇和内皮素-1水平升高,以及电解质异常。
有了前车之鉴,后来进入临床的几款CETP抑制剂均没有显示出脱靶效应特征,且具有良好的安全性,然而却因为没有达到预期疗效而终止了研究,包括罗氏的dalcetrapib(引进自日本烟草)和礼来的evacetrapib。2017年10月,默沙东宣布将不再寻求其CETP抑制剂anacetrapib的监管批准,理由是该药物的临床研究结果不支持上市申请,在3期研究中,anacetrapib仅使心脏病发作及死亡风险降低9%,同时,该药物会在脂肪组织中积聚,这使得商业化前景更不明朗。同一年,安进也宣布停止其CETP抑制剂AMG 899(Obicetrapib)的内部开发,并寻求对外许可机会,业界推测极大可能是受到了默沙东放弃递交anacetrapib上市申请的影响。
👀 曾经的最后一个CETP抑制剂并未退场
安进的AMG 899(Obicetrapib)前称为TA-8995,由安进在2015年以15.5亿美元收购荷兰生物技术公司Dezima Pharma而得。根据药融云数据提供线索,TA-8995由日本田边三菱制药株式会社(MTPC)最早进行研发,后授权给了Dezima Pharma,MTPC则保留了在亚洲某些地区(包括日本)的开发和商业化权利。

截图自药融云数据库
而本文的主角NewAmsterdam Pharma(以下简称NAP)在2020年从安进手中重新收购了Dezima Pharma,获得了Obicetrapib。NAP由荷兰阿姆斯特丹大学学术医学中心血管医学系的名誉医学教授John Kastelein博士和风险投资公司Forbion于2019年创立。而Dezima Pharma也是由John Kastelein教授于2012年创立,并受到了Forbion的资助。当2017年安进宣布停止Obicetrapib的内部开发并寻求对外许可之时,Forbion认为这种药物可以解决非常大的未满足医疗需求,并开始与安进公司对话,以继续开发该资产。为此Forbion与John Kastelein教授联合成立了NAP,目前Kastelein教授担任该公司的首席科学官。

2021年1月,NAP完成了1.96亿美元(1.6亿欧元)的A轮融资,由Forbion、Morningside Ventures和Ascendant BioCapital领投。从而支持Obicetrapib的3期临床开发。(相关阅读:1.96亿美元A轮融资,用于CETP抑制剂III期临床)
2022年6月,NAP与意大利制药公司美纳里尼集团签订了Obicetrapib在欧洲商业化的独家许可协议,同时保留在世界其他地区商业化Obicetrapib的所有权利(如果获得批准),以及开发某些形式的Obicetrapib用于治疗其他疾病(如阿尔茨海默病)的权利。
2022年7月,NAP宣布与特殊目的收购公司Frazier Lifesciences Acquisition Corporation达成合并协议,合并后的新公司在纳斯达克上市,股票代码为“NAMS”。
👀 研究重点的转变
最初在开发用于降低ASCVD(动脉粥样硬化性心血管疾病)风险的CETP抑制剂时,大家关注的重点在于其提高HDL-C(高密度脂蛋白胆固醇,俗称“好胆固醇”)的能力,但是现在CETP抑制剂的开发重点已确定为降低LDL-C(低密度脂蛋白胆固醇,俗称“坏胆固醇”)、非HDL-C和ApoB(载脂蛋白B)的能力,并受到了动物模型、观察性队列、孟德尔随机化研究、随机对照试验和大型荟萃分析等综合证据的支持。
根据NAP披露,与先前的几款CETP抑制剂相比,Obicetrapib具有内在特性,如可电离特性,且亲脂性显著降低,因此该公司认为与其他CETP抑制剂相比,Obicetrapib作为候选药物具有更有利的物理、药代动力学和生物制药特性。将Obicetrapib与等效剂量的anacetrapib和evacetrapib相比,以及10mg剂量的Obicetrapib与100mg剂量的anacetrapib相比,Obicetrapib被证明可以更大程度地降低CETP活性。

在NAP开展2b期ROSE试验中,在高强度他汀类药物的基础上,10 mg剂量Obicetrapib治疗显示LDL-C较基线降低51%;在2期ROSE2试验中,10 mg剂量Obicetrapib联合10 mg剂量依泽替米贝治疗显示LDL-C较基线降低了63%,研究达到了主要和次要终点。在评价Obicetrapib作为单药疗法或与10 mg依泽替米贝联用的5项2期临床研究(TULIP、ROSE、OCEAN、ROSE2以及在日本的2b期试验)中,均观察到LDL-C水平具有统计学意义的降低,其副作用的频率和严重程度与安慰剂相似。在NAP迄今开展的临床试验中,Obicetrapib在800多名血脂异常的患者中显示出良好耐受性。
鉴于研究观察到的LDL-C降低能力和安全性,NAP选择10mg剂量的Obicetrapib开展3期临床研究,并设计了专门的心血管获益研究(CVOT),旨在避免以前CETP抑制剂研究方案的缺点,并期望最终能够满足那些尽管接受目前最佳降脂治疗但LDL-C水平仍然升高的ASCVD(动脉粥样硬化性心血管疾病)和/或HeFH(家族性高胆固醇血症)患者的未满足治疗需求。
此外,NAP认为,Obicetrapib的口服递送、低剂量、化学特性和耐受性使其非常适合于联合治疗。该公司也正在开发Obicetrapib10 mg + 依泽替米贝10 mg的固定剂量组合。
👀 单药、联合疗法3期临床推进中
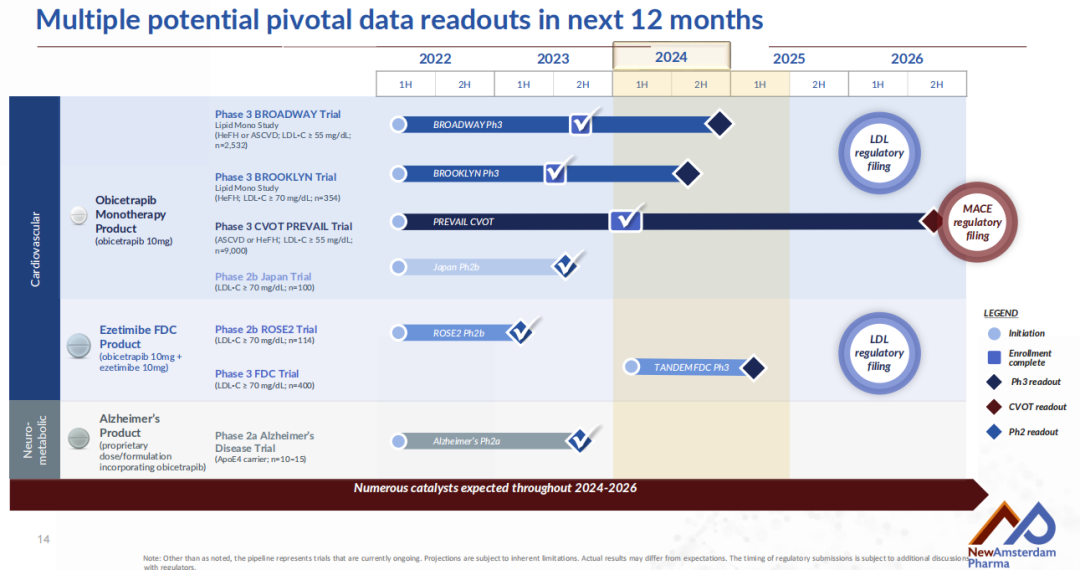
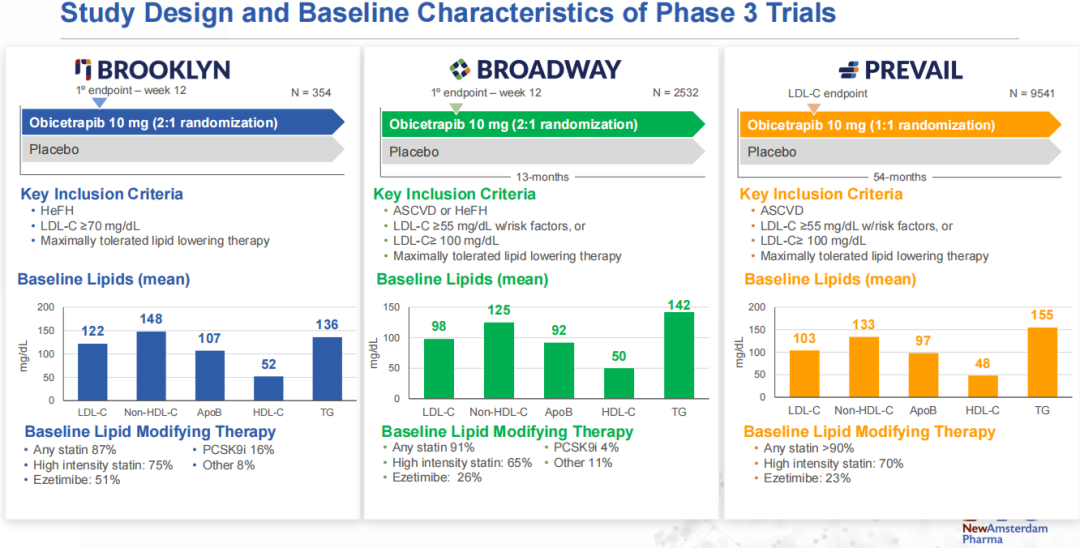
目前,NAP围绕Obicetrapib作为单药疗法开展了2项关键3期临床试验,即BROADWAY和BROOKLYN,以评估Obicetrapib作为最大耐受剂量降脂疗法的辅助疗法,以潜在地进一步降低ASCVD或HeFH患者的LDL-C水平。这两项研究已在2023年完成入组,BROADWAY研究随机分配了超过2500名患者,BROOKLYN研究随机分配了超过350名患者。该公司预计将分别于2024年Q3和Q4公布BROOKLYN研究和BROADWAY研究的顶线数据。
2022年3月,NAP启动了3期CVOT(心血管获益)研究PREVAIL,旨在评估Obicetrapib减少MACE(主要心血管事件,包括心血管疾病死亡、非致死性心肌梗死、非致死性中风和非选择性冠状动脉重建术)发生率的潜力,该研究于2024年4月完成患者入组,随机分配了超过9500名患者,预计将于2026年公布顶线数据。
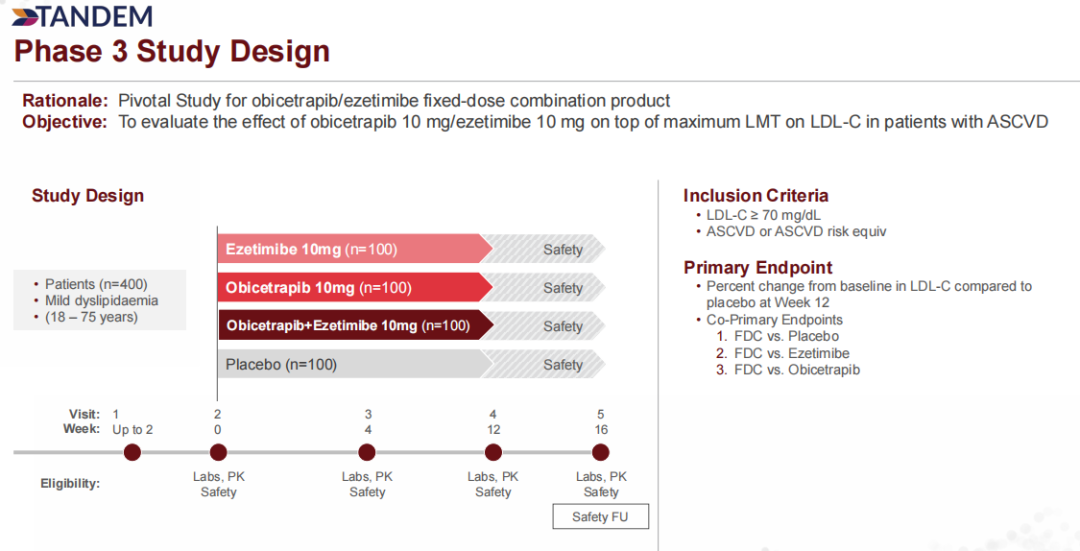
对于联合疗法,NAP基于2期ROSE2临床试验的积极结果与经验,以及在2023年上半年完成的Obicetrapib 10 mg + 依泽替米贝10 mg固定剂量组合与原型药物的生物等效性实验,公司在2024年3月启动了关键3期临床试验TANDEM,以评估Obicetrapib 10 mg + 依泽替米贝10 mg固定剂量组合作为饮食控制和最大耐受剂量降脂疗法的辅助治疗,潜在地进一步降低HeFH、ASCVD或ASCVD高风险患者LDL(低密度脂蛋白)水平的能力。该研究计划在美国招募约400名基线LDL-C≥70 mg/dL的患者,预计将在2025年Q1公布顶线数据。NAP的目标是在递交Obicetrapib单药的NDA后不久,再递交一个固定剂量组合的NDA申请。
NAP计划在美国、欧盟、日本、中国和英国寻求Obicetrapib的批准。药融云数据显示,Obicetrapib在国内正同步进行3期临床研究,主要临床机构为北京大学第一医院。

截图自药融云数据库
👀 阿尔茨海默氏症、糖尿病的尝试
NAP认为,CETP抑制也可能通过潜在地降低诸如阿尔茨海默氏症或糖尿病等疾病的发展风险,在其他适应症中发挥作用。有证据表明,大脑中胆固醇的积累是阿尔茨海默氏病的前兆。例如,缺乏CETP基因的啮齿类动物对阿尔茨海默氏病有抵抗力。在早期的临床前研究中,当人类的CETP基因被敲入小鼠,小鼠大脑中的胆固醇含量增加了25%;当与淀粉样前体蛋白(假设是阿尔茨海默病的驱动因素)的基因结合时,在双转基因小鼠中观察到患类似阿尔茨海默病的疾病的风险大大增加。在一项临床前研究中,该公司观察到CETP抑制促进了大脑中胆固醇的清除并改善了认知能力。
NAP于2022年初开始了一项2a期开放标签和单臂试验,用于早期阿尔茨海默病和载脂蛋白E4(ApoE4)发生自然变异的患者,以评估Obicetrapib的药效学和药代动力学效应、安全性和耐受性,共13例患者给予Obicetrapib 10 mg,随访24周。2023年9月,该公司宣布了该试验初步数据,与基线水平相比,患者脑脊液中24-羟基胆固醇和27-羟基胆固醇的水平分别降低了11%和12%。此外,患者血浆中Aβ42/40比值较基线增加了8%,pTau181水平稳定。

以往的CETP抑制曾在3期CVOT(心血管获益)研究中显示出抗糖尿病益处,若Obicetrapib也能显示出抗糖尿病益处,它将区别于目前的治疗方案,特别是与他汀类药物相比(他汀类药物可能致新发糖尿病的风险存在剂量依赖性)。NAP计划开展临床前研究以探索Obicetrapib治疗糖尿病患者的潜力,并已经将新发2型糖尿病作为Obicetrapib的3期CVOT研究PREVAIL的一个终点。

👀 财务状况
2023全年,NAP公司总收入为1410万美元,而上一年同期为1.027亿美元,这一下降主要是由于2022年收到了美纳里尼的预付款;2023年R&D费用为1.594亿美元,上一年同期为8670万美元,这一增长主要与正在进行的3期临床试验有关;SG&A费用为3760万美元,上一年同期为1950万美元,主要是因为公司人员增长。2023全年净亏损为1.769亿美元,或每股亏损2.15美元。

2024年Q1,NAP公司总收入为140万美元,而2023年同期为860万美元,这一下降主要是由于去年同期获得了临床相关里程碑收入;第一季度R&D费用为4240万美元,而2023年同期为4040万美元;SG&A费用为1450万美元,而2023年同期为810万美元,这一增长主要是由于团队扩张等,以支持Obicetrapib的商业化推出(若获得批准)。第一季度净亏损为9380万美元,或稀释后每股亏损1.06美元。

2024年2月,NAP宣布以1.753亿美元公开发行普通股和预融资认股权证,截至2024年3月31日,NAP拥有4.811亿美元的现金。截至7月4日,该公司市值约为18亿美元。截止发稿前市值为15.52亿美元,每股17.25美元。
👀 结语
从田边三菱最早研发TA-8995(Obicetrapib)开始,这一分子在多年间几经转手,目前正处于关键3期临床研究阶段。今年6月,美国专利及商标局为Obicetrapib颁发了第三代物质组合物专利,该专利将Obicetrapib的知识产权保护和排他性延长至2043年7月。NewAmsterdam Pharma能否借助前面几家大厂的经验与教训将Obicetrapib推向成功?业内对CETP抑制剂的研发热情会重燃吗?我们可以拭目以待。
参考来源:
[1] CDE/NMPA官网
[2] 药融云数据库
[3] FDA/EMA/PMDA
[4] 相关公司公开披露(正文图片均来自企业官方,除非另有说明)
https://www.newamsterdampharma.com/;
Kastelein, John J P et al. “Obicetrapib: Reversing the Tide of CETP Inhibitor Disappointments.” Current atherosclerosis reports vol. 26,2 (2024): 35-44. doi:10.1007/s11883-023-01184-1;
https://www.amgen.com/newsroom/press-releases/2015/09/amgen-to-acquire-privately-held-dezima-pharma;
https://www.businesswire.com/news/home/20200825005160/en/NewAmsterdam-Pharma-Acquires-Obicetrapib-from-Amgen;
https://www.prnasia.com/story/366920-1.shtml;等等
相关扩展阅读:
[1] 2024年心血管疾病全球流行病学概况丨流行病学、危险因素与政策动向
[3] 中国心血管系统药物分析报告
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论