
一年之计在于春。
据不完全统计,2023年1月,国内有16家药企喜迎开门红,涉及到新药获批、医保斩获、出海成功以及完成大额融资等,为全年打下好基础。
喜鹊医药:枝头报喜讯。
恒瑞医药:医保收获颇多,创新不断推进。
和黄医药:出海开门红。
传奇生物:销售和研发“双传奇”。
艾迪药业:1类创新药获批上市。
荣昌生物:RC28-E治疗湿性年龄相关性黄斑变性Ⅲ期临床试验启动
和铂医药:孵化企业HBMAT完成种子轮融资。
华润生物:完成6亿元的B轮融资。
驯鹿生物:完成5亿元C1轮融资。
惠升生物:完成5.8亿元A+ 轮融资。
金斯瑞蓬勃生物:完成2.2亿美元C轮融资。
亚盛医药:完成配股融资约5.5亿港元
康方生物:合作方Summit付款3亿美元到账。
辉大基因:首个基因治疗药物美国IND获批
绿叶制药:创新微球制剂Rykindo出海成功
银诺医药:苏帕鲁肽两项III期临床研究达到主要疗效终点
一、恒瑞医药:医保收获颇多,创新不断推进
目前,恒瑞医药进入国家医保药品目录的产品累计达93个,包括11款创新药。
恒瑞医药已有瑞维鲁胺、达尔西利、卡瑞利珠单抗等11个创新药获批上市,公司引进的1类新药林普利塞也已获批上市,另有60多个创新药正在临床开发,260多项临床试验在国内外开展,并建立起一批具有自主知识产权、国际领先的新技术平台,为不断产出创新成果提供强大基础保障(《恒瑞医药久违的涨停板!新药研发管线实力雄厚,12款已商业化》)。
据恒瑞医药公众号消息:
1月13日,我国首个高选择性PI3Kδ抑制剂林普利塞(因他瑞®)开出首批处方,惠及广大淋巴瘤患者。BD开花结果,林普利塞是恒瑞引进的1类新药。
1月15日,恒瑞医药广谱抗肿瘤药物环磷酰胺胶囊国内获批上市。环磷酰胺对易感恶性肿瘤单独有效,更常与其他抗肿瘤药联合使用。环磷酰胺胶囊2013年9月在美国获批上市。经查询,2021年环磷酰胺相关剂型全球销售额约为3.25亿美元。
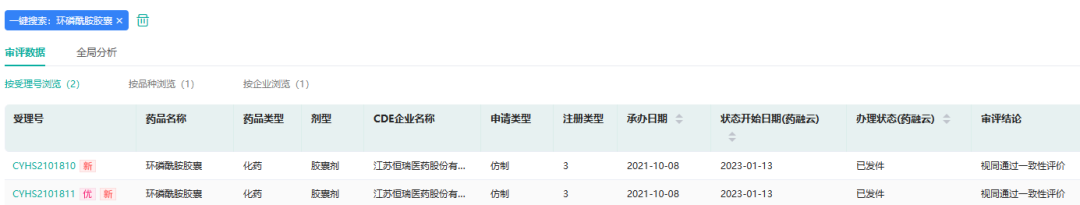
截图来源:药融云中国药品审评数据库
1月16日,恒瑞医药糖尿病复方制剂瑞格列汀二甲双胍片上市申请获受理。本品用于经饮食运动治疗或经二甲双胍单药治疗血糖仍控制不佳的2型糖尿病患者。经查询,2021年DPP-4抑制剂与二甲双胍复方制剂全球销售额约为119.32亿美元,属于重磅大品种。
1月18日,《国家基本医疗保险、工伤保险和生育保险药品目录(2022年)》公布。恒瑞医药多个重磅创新药和首仿产品纳入新版目录。至此,恒瑞医药进入国家医保药品目录的产品累计达93个,其中公司已上市的11款创新药全部进入医保,进一步提高患者用药可及性和可负担性。
二级市场上,截止1月20日,恒瑞医药股上涨13%,市值即将突破2800亿元,逐渐走出低谷。
二、和黄医药:出海开门红
2023年1月18日,和黄医药宣布,沃瑞沙获纳入国家医保。新版医保药品目录将自2023年3月1日起生效。沃瑞沙®于2021年6月在中国获附条件批准,用于治疗特定的MET外显子14跳跃突变的非小细胞肺癌患者。
据药融云数据库,阿斯利康的赛沃替尼2021年营收1600万美元,国内医院销售数据季度趋势如下:
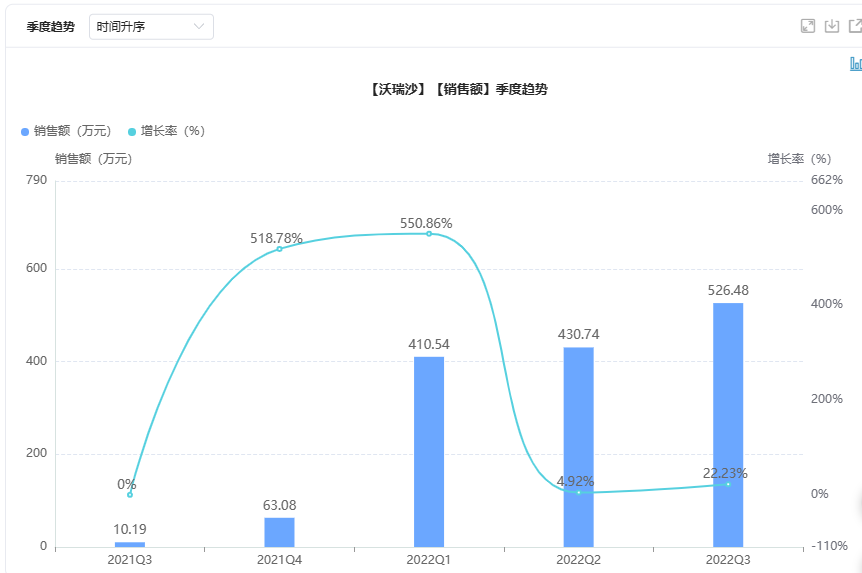
截图来源:药融云全国医院销售数据库
1月23日,和黄医药宣布与武田制药达成呋喹替尼中国以外地区开发及商业化许可协议。协议完成时,和黄医药将可收取首付款4亿美元,以及可高达7.3亿美元的潜在未来里程碑付款,总额可高达11.3亿美元,并外加基于净销售额的特许权使用费,公司 计划于2023年完成在美国、欧洲和日本的上市许可申请提交 。
此外,2023年1月4日,和黄医药创新药物索乐匹尼布治疗重型/危重型新型冠状病毒(COVID-19)感染患者的II期临床试验在上海复旦大学附属华山医院实现首例患者用药。去年12月,和黄医药开始向美国FDA滚动提交呋喹替尼用于治疗难治性结直肠癌的新药上市申请。
三、传奇生物:销售和研发“双传奇”
2023年1月12日,CDE官网显示,传奇生物的西达基奥仑赛上市申请拟纳入优先审评。
2023年1月24日,Legend Biotech公告,2022年Q4细胞疗法CARVYKTI销售额0.55亿美元。去年Q2首季销售约0.24亿美元,Q3约0.55亿美元;2022年全年合计1.34亿美元,约为人民币9.1亿人民币(1美元=6.7843人民币)。Carvykti是全球第2款BCMA CAR-T疗法,2022年2月28日获FDA批准上市,合作伙伴强生预计峰值有望达到50亿美元。

截图来源:药融云中国药品审评数据库
2023年1月27日,金斯瑞生物公告,CARTITUDE-4(一项评估CARVYKTI(ciltacabtagene autoleucel; cilta-cel)治疗复发性和来那度胺难治性多发性骨髓瘤成年患者的三期研究)达到了其主要终点,即在该研究的第一个预先指定的中期分析中该治疗与标准疗法相比,无进展生存期(「PFS」)在统计学上有显著改善。根据临床试验资料监查委员会的建议,该研究已经揭盲。
Legend Biotech研发管线

四、喜鹊:枝头报喜讯
喜鹊枝头叫,喜讯天天报。
除夕之日,广州喜鹊医药有限公司收到美国食品药品监督管理局(FDA)临床试验许可(IND):1类化学创新药物MN-08用于治疗特发性肺动脉高压(PAH)成功获准在美开展药物临床试验,这也是喜鹊医药在FDA获得的第2项药物的IND。
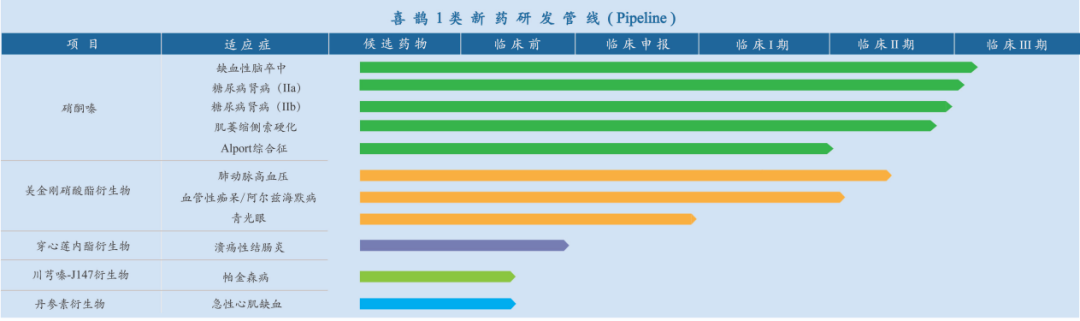
喜鹊医药MN-08片于2019和2021年已经先后成功获得中国国家药监局(NMPA)批准用于治疗特发性肺动脉高压和阿尔茨海默病(AD)药物IND,并且已经在中国完成了I期临床试验,显示出良好的安全性和耐受性,目前正在中国进行II期临床试验,有望成为全新的治疗PAH和AD的创新药物,为患者带来更好的获益,造福更多患者家庭。

截图来源:药融云数据库中国临床试验
五、艾迪药业:1类创新药获批上市
2023年1月4日,药监局官网显示,艾迪药业的1类创新药艾诺米替片(商品名:复邦德)获批上市。艾诺米替本品为艾诺韦林、拉米夫定和富马酸替诺福韦二吡呋酯组成的复方制剂,用于治疗成人HIV-1感染初治患者。这是2023年第一款获得国家药监局批准上市的1类新药,同时也是国产首个三合一(三种成分形成的单片给药)艾滋病新药。据药融云数据库,中国药品审评情况如下:
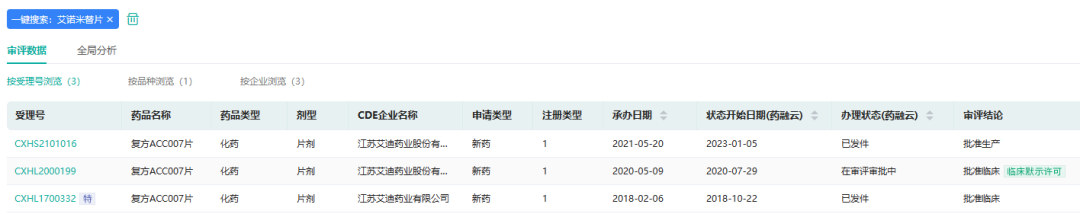
截图来源:药融云中国药品审评数据库
根据III期临床研究试验结果显示,艾诺韦林片在安全性上表现优异,能显著减少头晕、睡眠障碍等中枢神经系统不良反应、脂代谢指标控制良好、肝毒性低和皮疹发生率低;其抗病毒有效性与对照组的依非韦伦相当,能够快速降低患者体内病毒载量,对高低基线病毒载量均抑制有效且疗效持续稳定。
六、驯鹿生物:完成5亿元C1轮融资
2023年1月18日,驯鹿生物,宣布完成近5亿元人民币C1轮融资。本轮募得资金主要用于公司产品管线的研发和临床推进以及核心产品伊基仑赛注射液的商业化运营。
据药融云数据库,2022年6月,信达生物和驯鹿医疗合作的伊基仑赛注射液(商品名:福可苏,驯鹿医疗研发代号:CT103A,信达生物研发代号:IBI326)申报上市,拟纳入优先审评审批,用于既往接受三线或以上系统性治疗后复发或难治性多发性骨髓瘤。这是国产首款申报上市的BCMA靶向CAR-T疗法,抢先传奇生物。
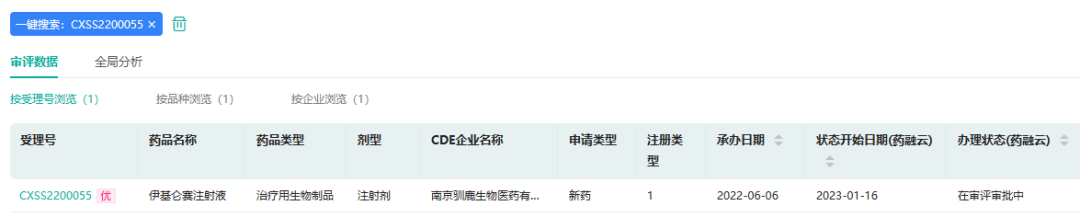
截图来源:药融云中国药品审评数据库
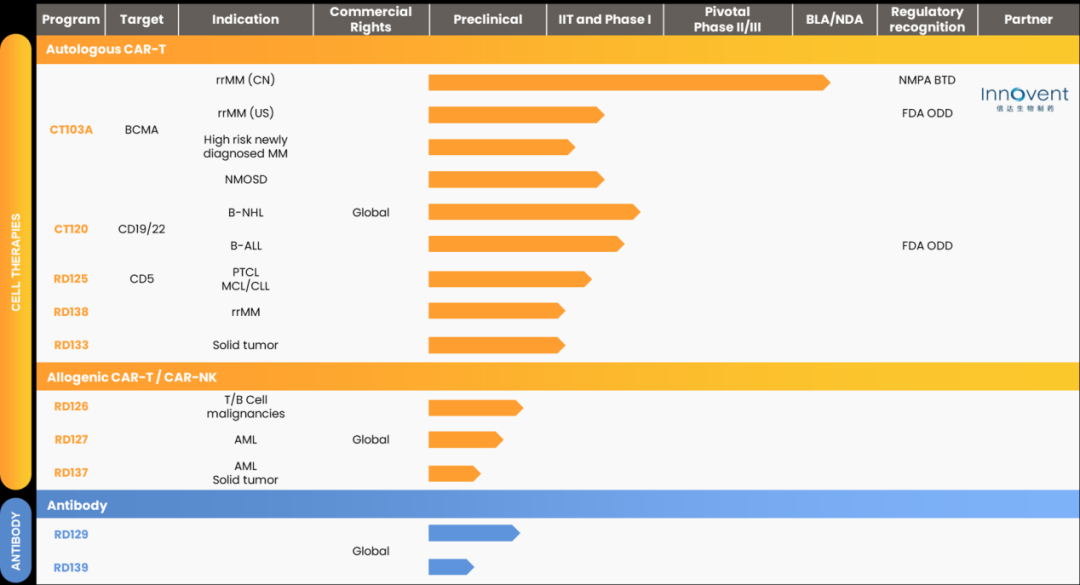
驯鹿生物专注于自主开发细胞治疗及抗体药物,凭借团队的高效创新、强执行力,现已拥有丰富的产品管线。
七、华润生物:完成6亿元的B轮融资
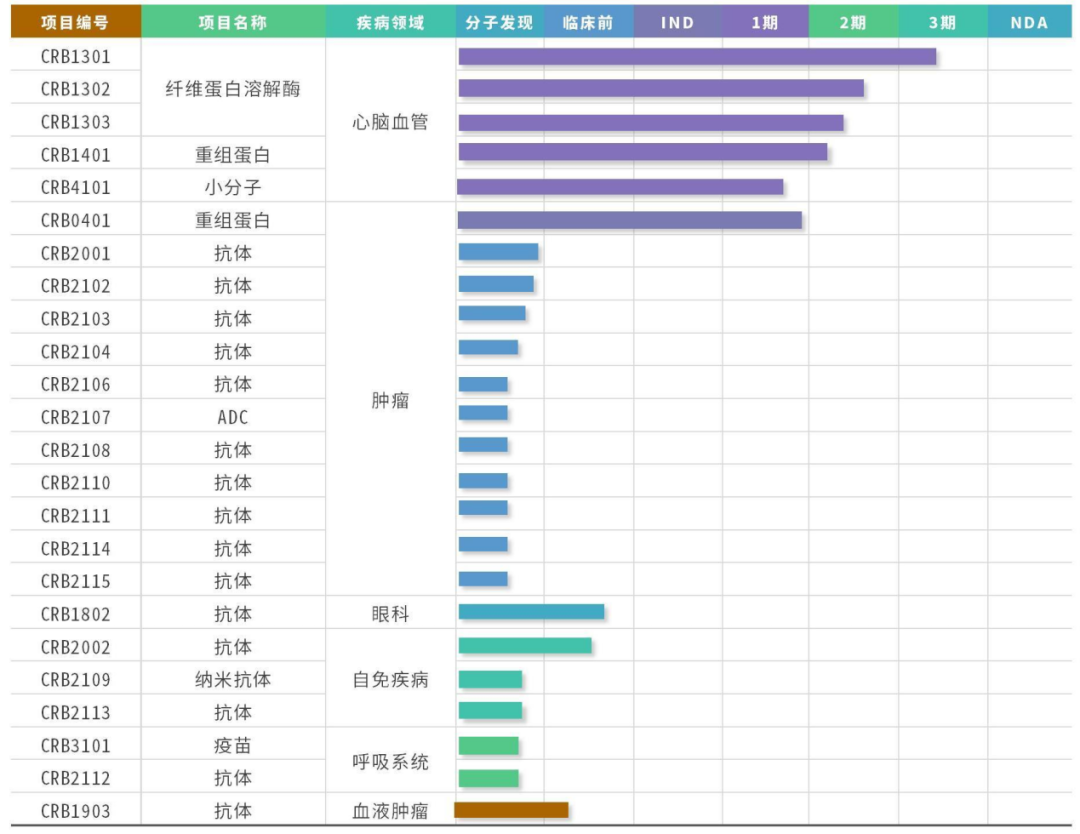
2023年1月10日,华润生物宣布完成6亿元的B轮融资,由国调基金领投,混改基金、建信股权、粤科基金、无锡国联跟投(《13起生物医药投融资事件!华润生物完成6亿B轮融资,加速新药研发》)。本轮融资将主要用于加速创新生物药的研究、临床试验阶段研发管线的推进以及外部项目的引进等。据公司官网, 目前在研品种共24个,其中6个处于临床研究阶段。公司持续专注重组蛋白、抗体以及创新生物技术的研发,提升核心竞争力。
八、惠升生物:完成5.8亿元A+ 轮融资
1月3日,四环医药附属惠升生物成功完成5.8亿元A+轮融资。惠升生物是国内大型医药及医美集团四环医药旗下专注糖尿病及并发症领域的生物医药公司。本次增资的资金主要用于惠升生物及其附属公司上市产品的市场推广、在研产品的临床推进及补充经营流动资金等用途。惠升生物成功完成本次增资体现了各投资方对惠升生物的研发实力及产业化能力的认可,对公司在糖尿病及并发症领域所布局的全产品管线的价值创造及未来广阔市场前景的信心和期待。

截图来源:药融云全球药物研发数据库
经过7年的建设和发展,公司目前拥有国际一流、具有丰富糖尿病药物研发经验的逾200人的研发团队,目前拥有糖尿病及并发症全产品管线40余款产品,涵 盖 全 系 列 二 代、三 代、四 代 胰 岛 素 及 类 似 物 产 品 管 线(覆 盖 基 础、预 混 及 速 效 产品)、最 新 机 制 的 创 新 药 制SGLT-2、GLP-1等产品以及其他各机制降糖药物和并发症药物。惠升生物是目前国内唯一实现糖尿病及并发症领域全产品覆盖,并集研发、生产、销售于一体的全产业链生物制药公司,致力于为糖尿病患者提供全程、全方位一体化的治疗解决方案,服务于患者,让健康变得更简单。
九、金斯瑞蓬勃生物:完成2.2亿美元C轮融资
2023年1月17日金斯瑞蓬勃生物宣布完成约2.2亿美元C轮融资,加速生物药及基因/细胞治疗CDMO业务产能扩张及技术平台升级。成立至今,蓬勃生物在生物药CDMO领域承接了80多个全球CMC及CMO项目,并帮助客户获得了超过20个全球IND批件。在基因及细胞治疗CDMO领域,作为行业最早的开拓者之一,蓬勃生物积累了超过60个全球CMC项目经验,以及超过20个IND项目成功申报经验,领跑行业。
十、康方生物:合作方Summit付款3亿美元到账
2023年1月26日,康方生物第一期首付款3亿美元到账!康方合作方Summit全力推动PD-1/VEGF双抗依沃西的海外临床开发。在2022年12月5日,康方生物与Summit以创纪录的交易方案,就康方生物自主研发的PD-1/VEGF双抗的海外部分权益授权达成合作。
康方生物管线分布概况

Summit获得依沃西在美国、加拿大、欧洲和日本的开发和商业化独家许可权。康方生物获得50亿美元里程碑款项(首付款5亿美元,其中第一期首付款将在HSR备案后到账,第二期首付款将在协议签署后90天内到账),以及依沃西销售净额低两位数比例提成。康方生物保留依沃西除以上4个地区之外的开发和商业化权利,包括中国。同时康方生物董事长夏瑜博士已被委任为Summit董事会成员。
十一、绿叶制药:Rykindo的出海成功
1月15日,由烟台大学药学院孙考祥教授团队在绿叶制药主持研发的创新微球制剂——Rykindo(利培酮缓释微球注射制剂,项目编号:LY03004)获FDA批准上市,用于治疗精神分裂症成人患者、以及作为单药或作为锂盐或丙戊酸盐的辅助疗法用于双相障碍I型成人患者的维持治疗。Rykindo是每两周肌肉注射一次的缓释微球制剂,其通过微球制剂以长效、缓释的方式递送有效成分利培酮至体内发挥作用。

截图来源:药融云全球药物研发数据库
这是2023年国产新药出海的第一例重大事件,值得一提的是,此次Rykindo的出海之路,自2015年10月7日宣布在美递交新药申请之日算起,历时长达8年。据绿叶制药集团研发国际高级副总裁孙志刚透露,公司2019年3月向FDA提交了Rykindo的上市申请,2023年1月获批,中间与FDA有过多次沟通。
“FDA的审评要求始终围绕三个要点,安全、有效、质量可控。对于Rykindo®,FDA跟我们详细沟通了很多问题,包括临床和药学方面,特别是对研发的小试研究、临床试验、工艺放大还有商业化生产等方面的问题,都问得特别仔细,现场检查的时候也详细看了很多批次的记录。”孙志刚表示。
十二、荣昌生物:RC28-E治疗湿性年龄相关性黄斑变性Ⅲ期临床试验启动
1月19日,荣昌生物制药(烟台)股份有限公司(688331.SH/09995.HK)宣布:RC28-E注射液治疗湿性年龄相关性黄斑变性(wAMD)的Ⅲ期临床试验正式启动。RC28-E是荣昌生物开发的用于治疗眼科疾病的全球首创VEGF/FGF双靶标融合蛋白药物,可同时阻断VEGF和FGF家族的血管生成因子,从而更有效地抑制血管异常生长。
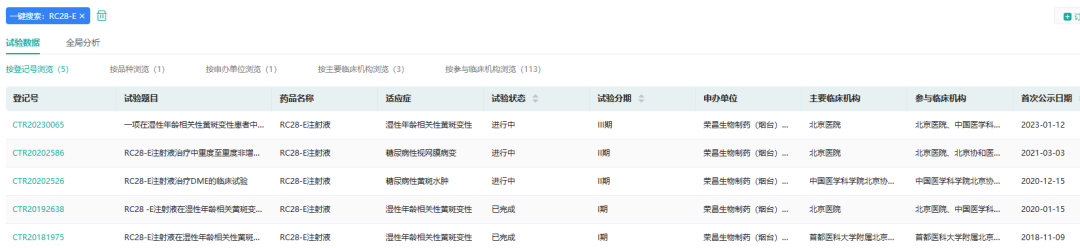
截图来源:药融云中国临床试验数据库
这是一项多中心、随机、双盲、阳性对照的Ⅲ期临床,旨在评价RC28-E注射液治疗湿性年龄相关性黄斑变性(wAMD)的有效性和安全性。研究的主要终点是第48周时眼最佳矫正视力(BCVA)相对于基线的变化均值。该研究由北京医院主任医师戴虹教授担任主要研究者,拟在76家医疗机构开展,招募432名患者。
十三、和铂医药:孵化企业HBMAT完成种子轮融资
1月26日,和铂医药(02142.HK)宣布,由和铂医药孵化的创新生物技术公司HBM Alpha Therapeutics(HBMAT)已完成种子轮融资,以推进其治疗先天性肾上腺增生症(CAH)和多囊卵巢综合症(PCOS)的创新抗体疗法,其主要候选项目正处于IND-enabling阶段。
HBMAT旨在为内分泌失调提供精确的治疗方法,其研发项目包括针对CAH和PCOS的治疗通路。此次融资所得将重点用于推动研发项目进入临床阶段。
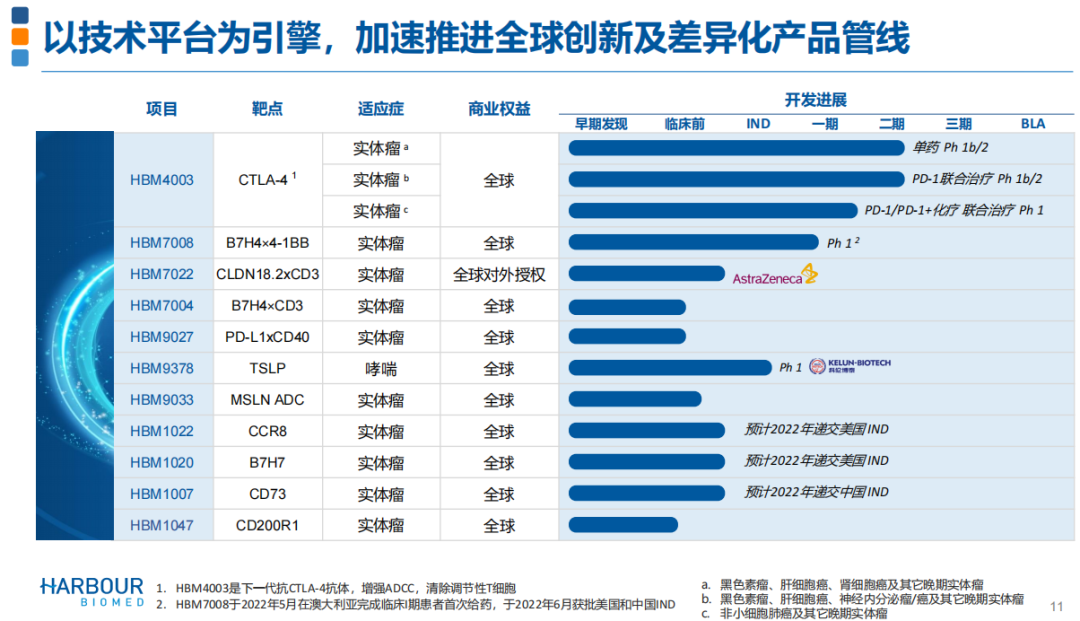
和铂医药创始人、董事长兼首席执行官及HBMAT董事会主席王劲松博士表示:“有机会探索罕见遗传性疾病CAH和影响女性健康的PCOS领域,针对其开发抗体疗法,我感到非常兴奋,我们很高兴能助力将这些前沿的项目提升到一个新的水平,并加速将这些具备强大生物学功能的治疗性抗体转化为临床价值,真正惠及更广大患者。”
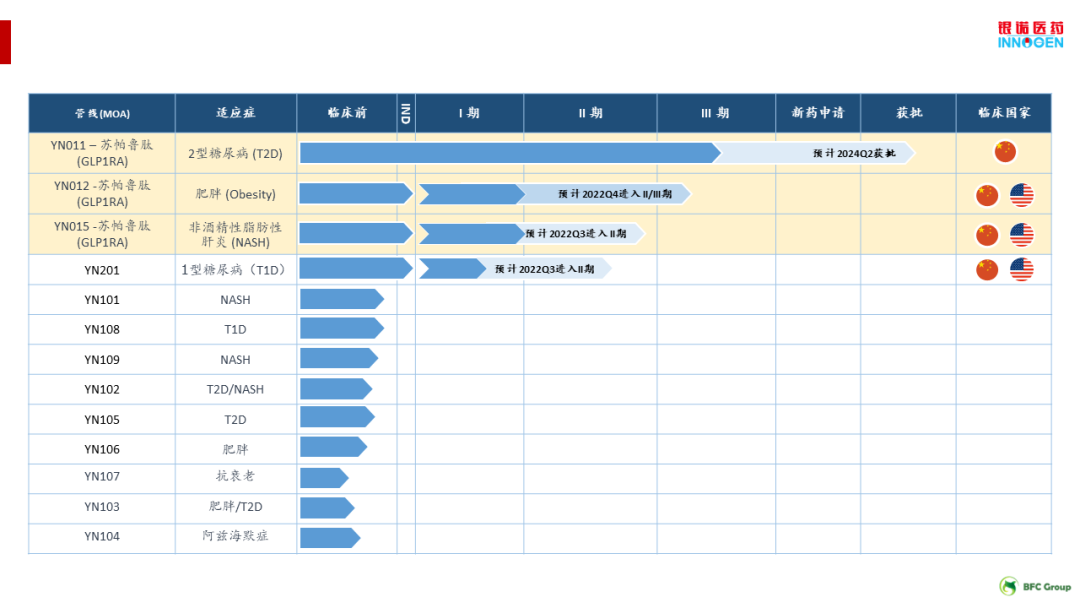
十四、银诺医药:苏帕鲁肽的两项III期临床试验达到主要疗效终点
1月26日,银诺医药宣布了苏帕鲁肽的两项III期临床试验达到主要疗效终点。苏帕鲁肽有望成为国内首个自主知识产权的人源、长效GLP-1受体激动剂。
2023年1月,银诺医药宣布YN011-301、YN011-302两项III期临床研究在前24周双盲治疗期达到主要疗效终点。两项研究共获得超过110个研究中心的支持,超过1100名2型糖尿病患者参与。疗效显著:苏帕鲁肽单药治疗24周后糖化血红蛋白相对基线降低超过2.0%,显著优于安慰剂组,P值小于0.001。安全性佳和耐受性良好:苏帕鲁肽治疗24周期间低血糖发生率低于2%。
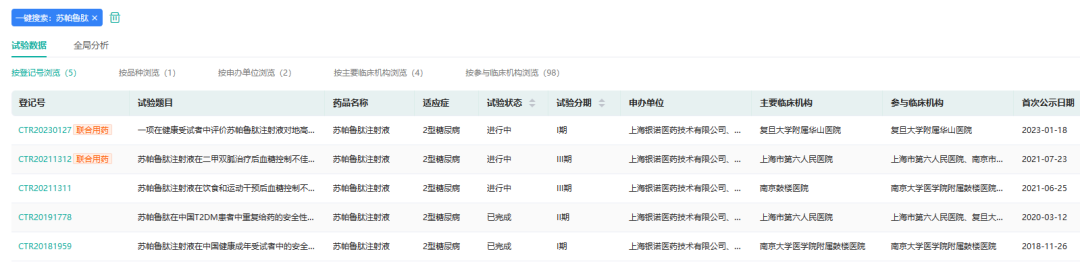
截图来源:药融云中国临床试验数据库
“我们对苏帕鲁肽III期临床研究结果非常兴奋,苏帕鲁肽上市后有望成为首个国产自主知识产权、人源长效的GLP-1受体激动剂,并具有成为同类最佳的潜力。” 银诺医药创始人,董事长兼CEO,王庆华博士表示。“银诺医药致力于成为全球领先的糖尿病代谢病领域的生物医药公司,向全球糖尿病、代谢病患者提供同类最优和同类首创药物。我们正在中国和美国申请开展多个临床研究,以探索苏帕鲁肽在其他代谢性疾病及相关领域的新用途。”
十五、亚盛医药:完成配股融资约5.5亿港元
1月18日,亚盛医药(6855.HK)宣布,公司与摩根大通集团、中金香港证券和花旗环球金融亚洲有限公司签订配售及认购协议,以每股24.45港元价格配售2250万股新股(先旧后新),预期认购事项将筹集的所得款项总额约为5.5亿港元。新股认购价格为24.45港元,较亚盛医药在2023年1月17日收市价每股折让约9.94%。配售及认购股份数额占比公司扩大后股本约7.83%。
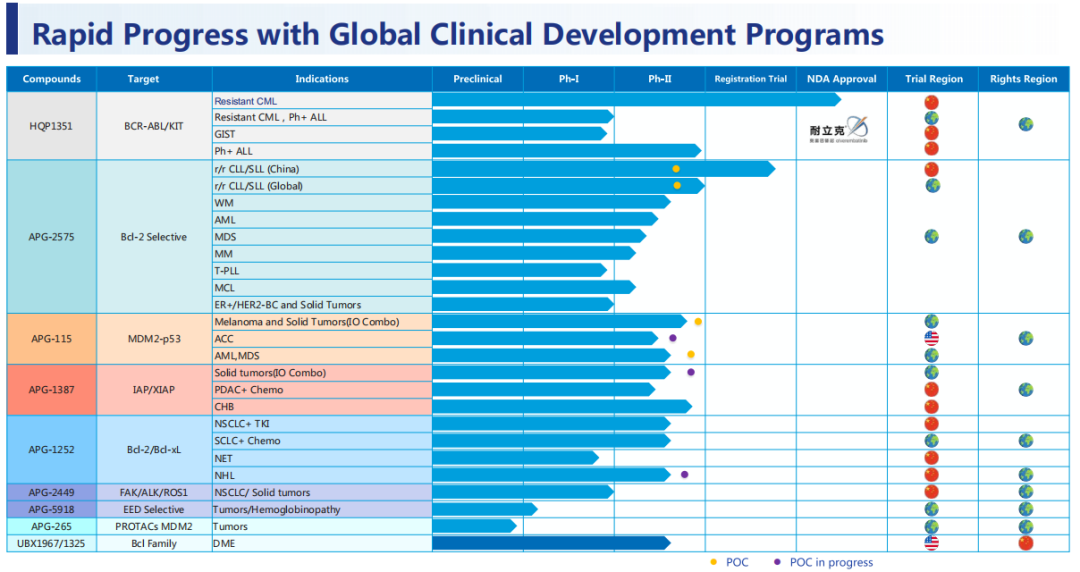
融资款项将主要用于管线产品的进一步临床开发及商业化,包括但不限于公司核心产品耐立克(奥雷巴替尼)、关键候选产品APG-2575及其他关键候选产品的临床开发与推进,以及一般公司用途等。
十六、辉大基因:首个基因治疗药物美国IND获批
2023年1月28日,辉大(上海)生物科技有限公司(以下简称“辉大基因”)宣布,公司的自主研发眼科基因治疗候选药物HG004近日获得美国食品药品监督管理局(FDA)授予新药临床试验(IND)许可,并将在多国开展用于治疗RPE65基因突变引起的相关性视网膜病变的国际多中心临床试验。HG004注射液是一种新型眼科基因治疗在研药物,旨在用于治疗RPE65基因突变相关性视网膜病变。
辉大基因融资情况
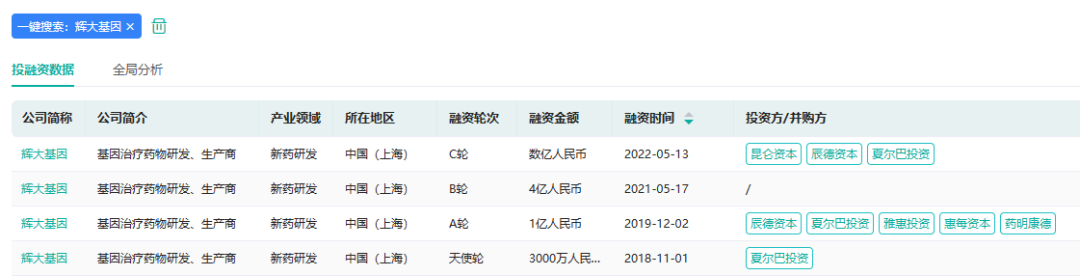
截图来源:药融云投融资数据库
“我们很高兴HG004项目获得FDA的IND许可,这不仅标志着公司首个IND许可的诞生,也意味着我们第一个视网膜疾病管线正式进入临床开发阶段。”辉大基因联合创始人、首席执行官姚璇博士表示,“HG004项目IND的获批,证明了辉大基因完善的in-house基因治疗管线开发能力,包括高质量的临床前试验,AAV工艺开发和分析方法开发,以及临床开发等全链条。同时通过与药明生基的合作,完成了GMP AAV的生产和质量研究。HG004项目旨在开发一种单次注射给药、非腺相关病毒血清型2(non-AAV2)的基因替代疗法,为全球因RPE65基因突变相关性视网膜病变而导致严重视力障碍或失明的儿童和成人患者提供治疗、恢复和预防的手段。”
辉大基因研发管线

总结
从以上国内16家药企开门红的情况来看,医保谈判落锤,降价有所缓和,多家药企受益;在融资上,有特色的公司总是能受到资本青睐,大额融资主要涉及到新药研发、细胞疗法、生物药CDMO等方面。出海方面,国内多家药企近几年出海斩获颇丰,从荣昌生物和科伦药业的ADC药物,传奇生物的car-t疗法、康方生物的PD-1/VEGF双抗以及绿叶制药的微球制剂等案例来看,除了和引进方国外药企的产品线有互补性以外,还有最重要的一点就是要按照FDA规则办事。
参考资料:
[1] 药融云数据库
[2] 各公司公告
想要解锁更多药企信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药企公司基本信息、投融资情况、产品管线分布、药物销售情况与各维度分析、药物研发情况、年度报告、最新进展动态、临床试验信息、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论