在中国,有一家创新药企:2016年9月成立,2021年7月上市,在不到5年的时间里一路顺利上市,众多明星机构持续加持,在国内众多生物药初创公司中,这家药企步伐很是独特。
市场布局上,全球自身免疫市场规模持续扩容,生物药占比不断加大,公司通过IL-4Rα抗体、TSLP单抗、MASP-2单抗等生物药差异化进入自免领域;
靶点选择上,公司具有高度前瞻性,10个产品中有5个临床阶段的候选药物进度均处于国内或全球前列;平台建设上,公司在单抗、ADC、双抗领域建立起一体化自主研发平台,平台下的研发能力卓越,平台下不同赛道的药物发展潜力异常强悍。
这就是康诺亚(香港联交所股票代码:2162.HK),一家深耕自身免疫性疾病、肿瘤疾病、专注研究创新单克隆抗体药物和其他治疗性蛋白药物研发与产业化的企业。在5年的时间里,这家年轻的药企让我们见证了一个企业从0到1,勇于挑战,走在前沿的勇气。

一、差异化进击自身免疫性疾病大道
2021年已经过去,但世界范围内对自身免疫性疾病药的临床急需程度却未曾减缓。自身免疫性疾病是指人体免疫系统错误地攻击机体的疾病,有100多种不同类型的自身免疫性疾病,几乎可以影响身体的任何部位,全球有大量患者需要用生物药来长期治疗自身免疫性疾病。
据弗若斯特沙利文预测,全球自身免疫性疾病药物市场预期将由2019年的1,169亿美元增加至2030年的1,638亿美元。全球自免药物市场中,生物药的市场份额预期将由2019年的66.8%增加至2030年的81.4%。中国自身免疫性疾病生物药市场预期2030年达到166亿美元。
中国拥有较大的自身免疫疾性疾病人群,中国自身免疫性疾病生物药市场预期将由2019年的5亿美元增加至2030年的166亿美元。值得一提的是,中国自身免疫性疾病药物市场中,生物药的市场份额预期将由2019年的22.7%增加至2030年的68.8%。
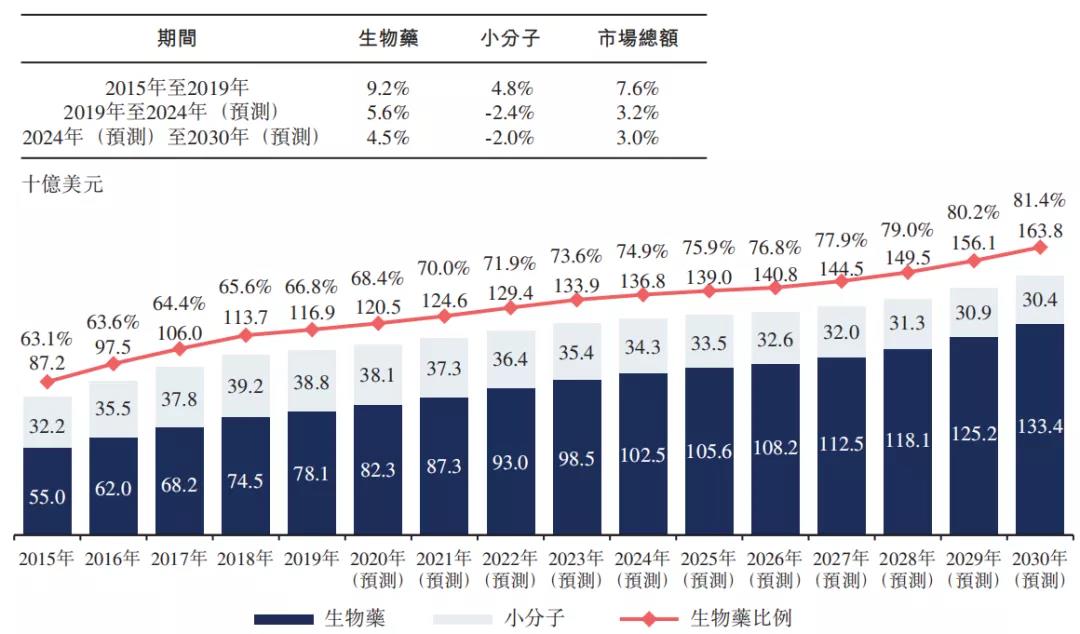
▲中国自免疾病药物市场,数据源:弗若斯特沙利文
过敏性疾病是由于与环境中无害的过敏原接触而导致的免疫系统超敏反应,从而引发自身免疫失调,常见的过敏性疾病包括特应性皮炎、慢性鼻窦炎、哮喘及食物过敏。根据弗若斯特沙利文资料显示,全球特应性皮炎患者预期2030年全球市场份额为234亿美元,赛诺菲╱再生元的度普利尤单抗是全球唯一获批用于治疗特应性皮炎的生物药;慢性鼻窦炎药物全球市场规模2030年预计达100亿美元,目前全球尚未批准任何生物药物用于慢性鼻窦炎不伴鼻息肉的治疗;全球哮喘患者全球市场份额预期2030年达到500亿美元,目前全球各地尚无任何小分子靶向药物获批用于治疗哮喘。
康诺亚的CM310是国内首家获批临床的IL-4R抗体,拟开展特应性皮炎、慢性鼻窦炎、哮喘临床研究。CM310是一类靶向IL-4R以拮抗IL-4/IL-13信号转导通路的全人源抗体药物,IL-4/IL-13信号通路在介导由Th2引起的Ⅱ型炎症反应中起到重要的作用,IL-4可以诱导Th0细胞和嗜碱性粒细胞极化成Th2细胞,并诱导B细胞产生的抗体类型由IgG转变为lgE,促进组胺、IL-5、嗜酸性粒细胞等炎症相关介质的释放,加重炎症反应,因此拮抗IL-4通路对于缓解炎症性过敏反应具有重要作用。
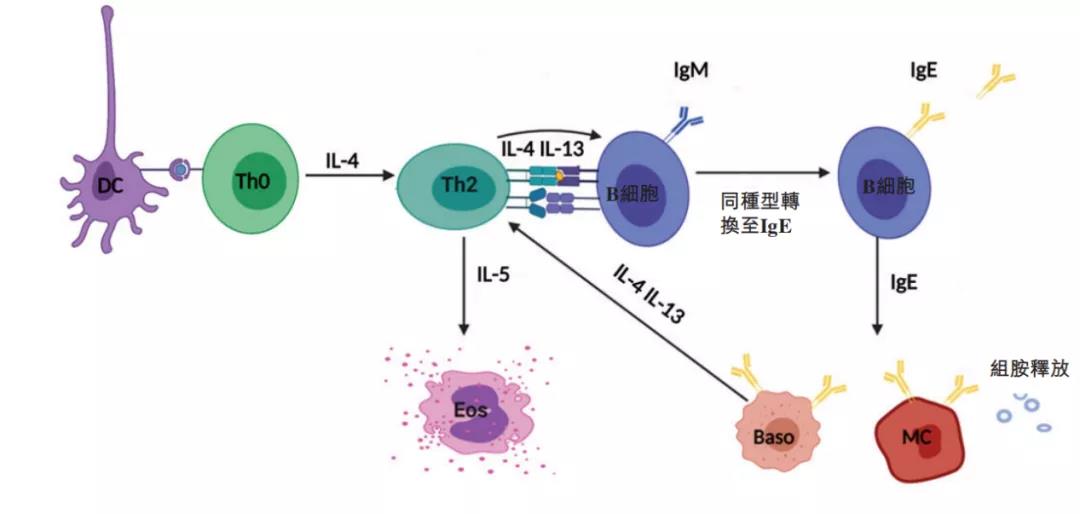
▲CM310作用机制
康诺亚的度普利尤单抗是全球唯一获批用于治疗特应性皮炎的生物药,自2017年上市以来,销售规模大幅增长,2017-2020年的销售收入分别为2亿、9亿、23亿、40亿美元。2020年6月,赛诺菲╱再生元的度普利尤单抗在中国获批,其销售表现强劲,于2020财年在中国销量即有13.7百万美元。
由于IL-4R药物显示出的市场潜力,国内数家企业纷纷布局IL-4R,康诺亚生物进度位列第一梯队。在国内原研中,其适应症拓展速度和广度上均处于领跑地位,2021年11月29日,CM310治疗特应性皮炎适应症的临床Ⅱb期获得积极数据结果,基于IIb期临床数据,康诺亚将迅速推进III期临床试验,并预计2023年将向NMPA递交NDA申请。
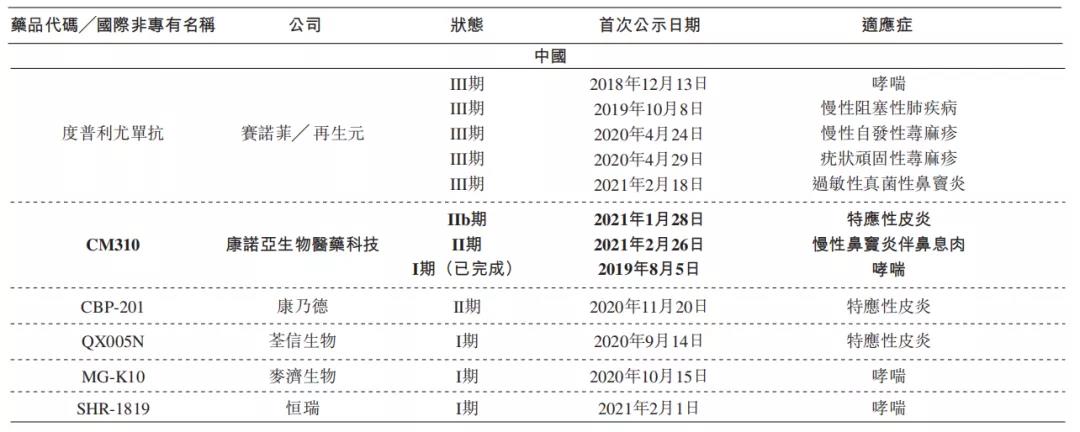
康诺亚的CM326通过靶向胸腺机制淋巴细胞生成素(TSLP)在哮喘、特应性皮炎等过敏性炎症上具有潜在治疗效果。安进/阿斯利康的tezepelumab进度全球第一获批上市,康诺亚生物CM326进度为全球第三,国内首家。
康诺亚的CM338是一种针对甘露糖结合凝集素相关丝氨酸蛋白酶2(MASP-2)的高效、人源化拮抗性抗体,补体系统在先天性及适应性免疫中起着关键作用,奥麦罗的narsoplimab为目前进度最领先的MASP-2抗体候选药(已向FDA提交BLA申请),2021年11月1日,康诺亚自主研发的国内首款靶向MASP-2创新性单克隆抗体药物CM338获得国家药品监督管理局药品审评中心(CDE)临床试验许可,计划未来继续开展包括IgA肾病在内的多项临床试验。
二、打造创新药公司的三匹现金牛
从当前的企业和市场状态来看,整个生物创新药行业呈现出“一家欢喜一家愁”的局面。
“愁”的是生物药公司都聚焦肿瘤,由于临床效果不算好,体量不算大,单个药物对上下游的议价能力偏弱,抗风险能力差,于是近些年不断有一些生物药公司黯然退出市场;
“喜”的则是一些公司根据优势聚焦差异化领域,在差异化领域不断投入研发守住战地,随着单小散生物公司加速出清,具备一定创新实力和管线推进能力的公司将逐步占据更大市场份额。
- CM310(IL-4Rα抗体)
CM310为康诺亚的核心产品,根据药融云数据:https://www.pharnexcloud.com/显示,CM310是首个国产且获得国家药监局的临床试验申请批准的IL-4Rα抗体。在临床前药理学研究中,CM310可有效阻断Ⅱ型免疫应答中所涉及的IL-4及IL-13诱导的信号传导及细胞增殖,CM310经证明可抑制IL-4或IL-13诱导的STAT6磷酸化,较度普利尤单抗更为有效。
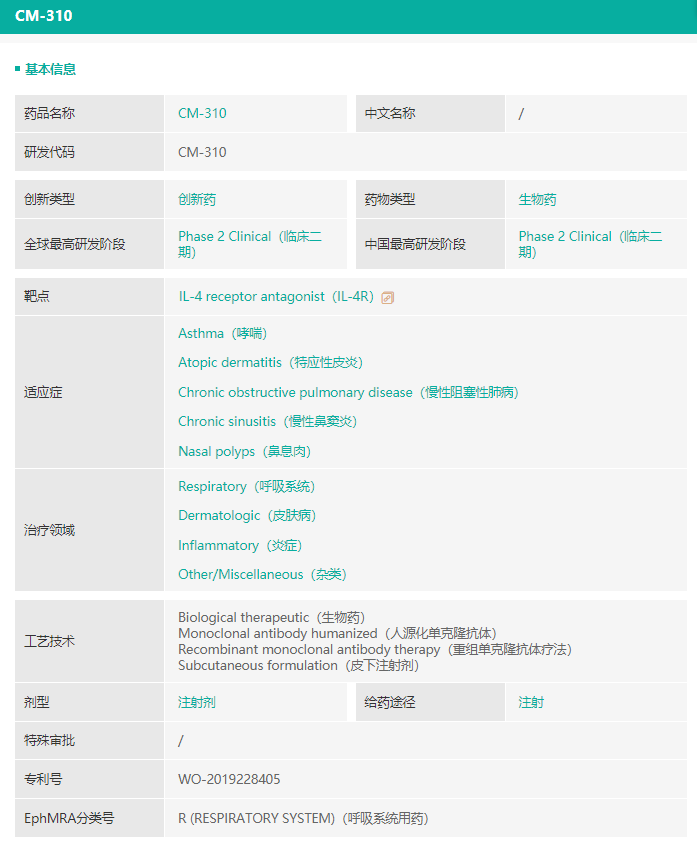
▲CM310(IL-4Rα抗体)情况,来源:药融云数据库
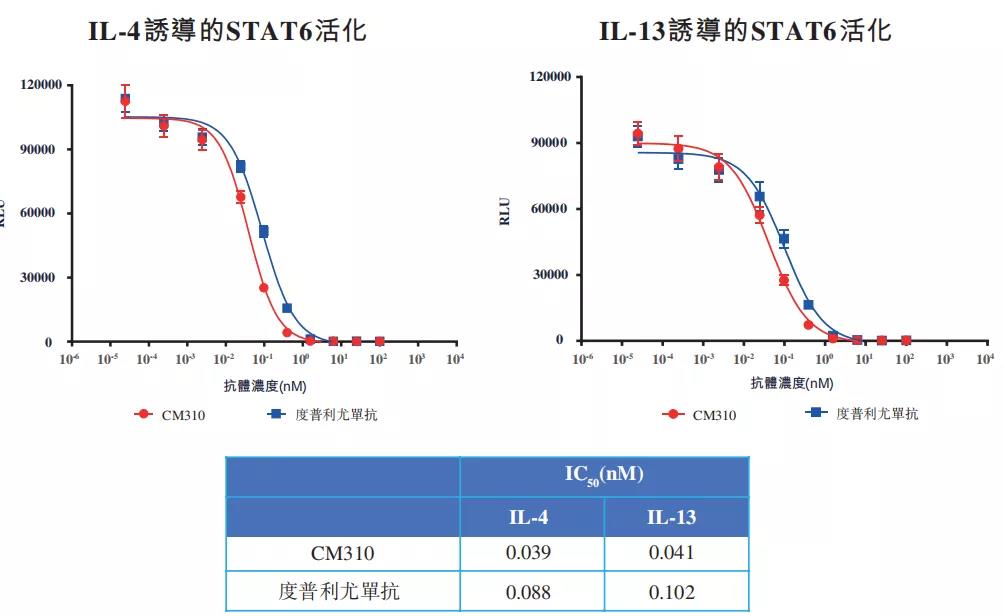
▲CM310与度普利尤单抗抑制IL-4或IL-13诱导的STAT6磷酸化对比情况
此外,康诺亚亦在TF-1细胞增殖试验中测试并比较了CM310及其竞争对手的生物活性,如下图所示,结果显示,CM310在抑制IL-4或IL-13诱导的TF-1细胞增殖方面的功效与度普利尤单抗相若或较之更高。令人满意的早期临床评价结果表明CM310有望成为广泛过敏性疾病的首选疗法之一。
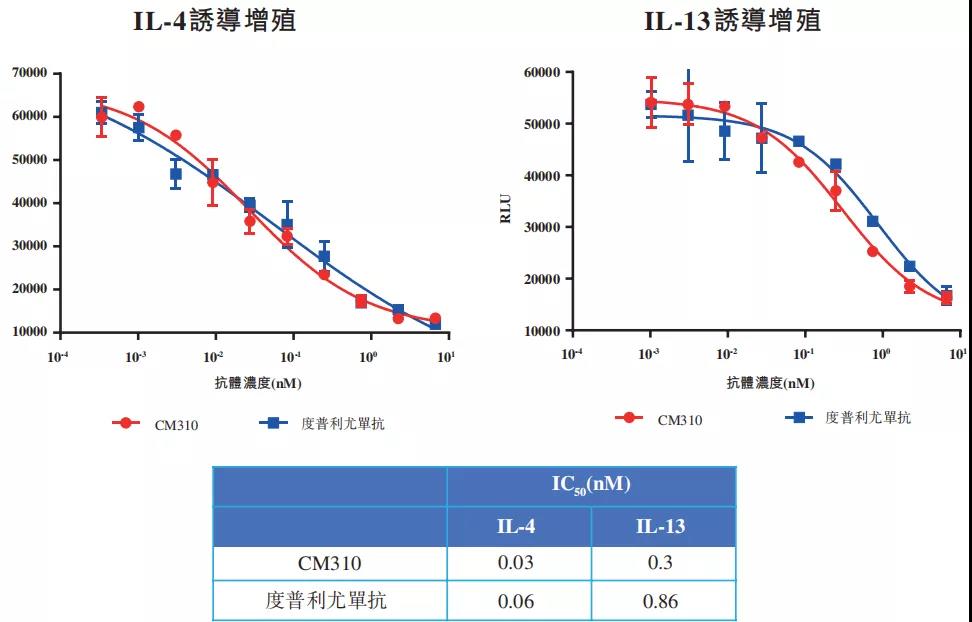
▲CM310与度普利尤单抗的细胞增殖试验测试情况
2021年11月29日,康诺亚CM310IIb期临床研究(CM310AD002)已完成数据揭盲及初步统计分析,研究结果显示,IIb期临床研究显示各剂量组主要关键终点均完全达标,基于IIb期临床数据,康诺亚将推进CM310Ⅲ期临床试验,同时也正在推动CM310在其他适应症中的临床研究,包括慢性鼻窦炎伴鼻息肉和哮喘。
- CM326(TSLP抗体)
CM326是康诺亚针对胸腺基质淋巴细胞生成素(TSLP)的高效、人源化单克隆抗体。安进╱阿斯利康的tezepelumab(首款已提交BLA申请的TSLP抗体)可有效控制哮喘发作严重程度,CM326在抑制TSLP方面的效果较tezepelumab类似物高出五倍以上。《石药津曼特和康诺亚CM326达成合作!1亿元首付款,TSLP单抗!》

▲CM326(TSLP抗体)情况,来源:药融云数据库
在临床前研究中,与tezepelumab类似物相比,康诺亚的CM326表现出更高的功效及更强的活性。如下图所示,尽管CM326与TSLP结合具有与tezepelumab类似物相似的亲合性,但CM326抑制TSLP诱导的细胞增殖的功效比tezepelumab类似物高出约6倍(根据公开数据内部得出)。
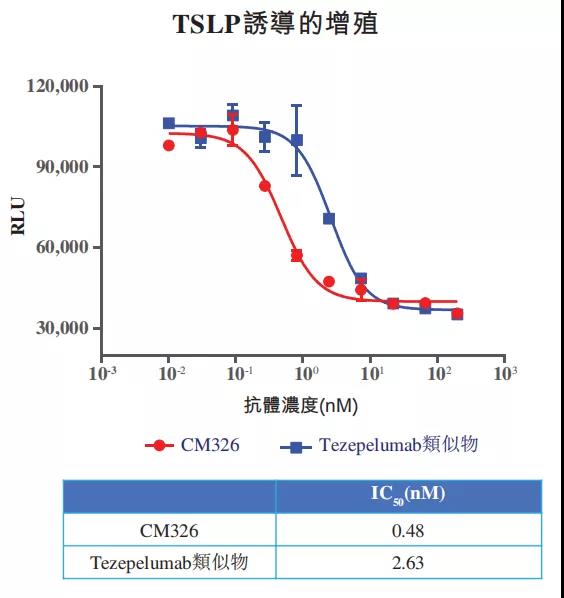
▲CM326与tezepelumab类似物抑制TSLP诱导的细胞增殖的功效对比情况
CM326在阻断TSLP诱导的JAK/STAT信号及Th2细胞因子释放方面,亦分别较tezepelumab类似物有高出约20倍及5倍的功效。
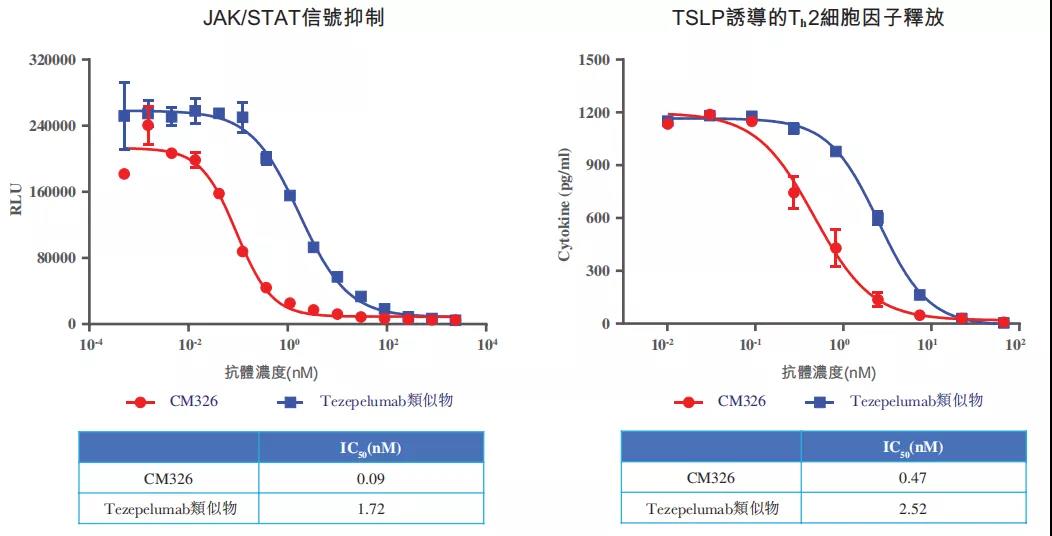
▲CM326与tezepelumab类似物在阻断TSLP诱导的JAK/STAT信号及Th2细胞因子释放方面对比情况
CM326是中国第一、全球第二个进入临床研究阶段的TSLP药物,目前已获得针对中重度哮喘、中重度特应性皮炎及慢性鼻窦炎伴鼻息肉适应症的临床试验许可。2021年11月,CM326注射液的I期临床研究(CM326HV001)获得积极的主要研究结果,随后进入临床II期研究。
- CMG901(Claudin 18.2抗体偶联药物)
胃癌是中国第二大常见的癌症,胃癌患病率高,然而胃癌患者的5年生存率仅为35.1%左右。Claudin18.2于胃癌、胰腺癌及其他实体瘤中的表达呈高度选择性及广泛性,使其成为癌症治疗的理想靶点,目前尚未在中国或全球范围内批准任何Claudin18.2抗靶向疗法上市销售。
CMG901是中国及美国首款获得临床试验申请批准的Claudin 18.2抗体偶联药物。康诺亚的CMG901与安斯泰来开发的处于临床阶段的领先Claudin 18.2抗体zolbetuximab类似物相比,体外研究显示,CM311介导的ADCC对Claudin 18.2表达的肿瘤细胞非常有效,杀灭率约为50%,而在相同条件下zolbetuximab类似物的杀伤率仅为30%。
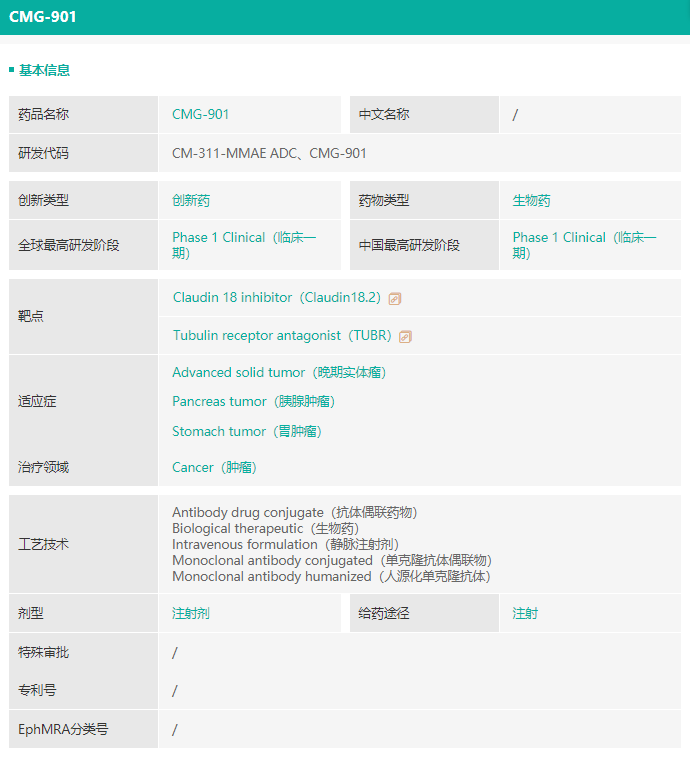
▲CMG901(Claudin 18.2抗体偶联药物)情况,来源:药融云数据库
在Claudin 18.2阳性胃癌及胰腺癌的人源肿瘤组织异种移植(PDX)模型体内研究中,CMG901剂量依赖性抑制肿瘤生长及肿瘤消退,在老鼠肿瘤模型研究中,CMG901抑制肿瘤生长的能力比母本Claudin 18.2抗体CM311更强。临床前安全性研究表明,CMG901药效佳、安全性优异,2021年2月,康诺亚CMG901-I期临床研究招募无标准治疗的晚期实体瘤受试者,目前已进入临床I期研究。
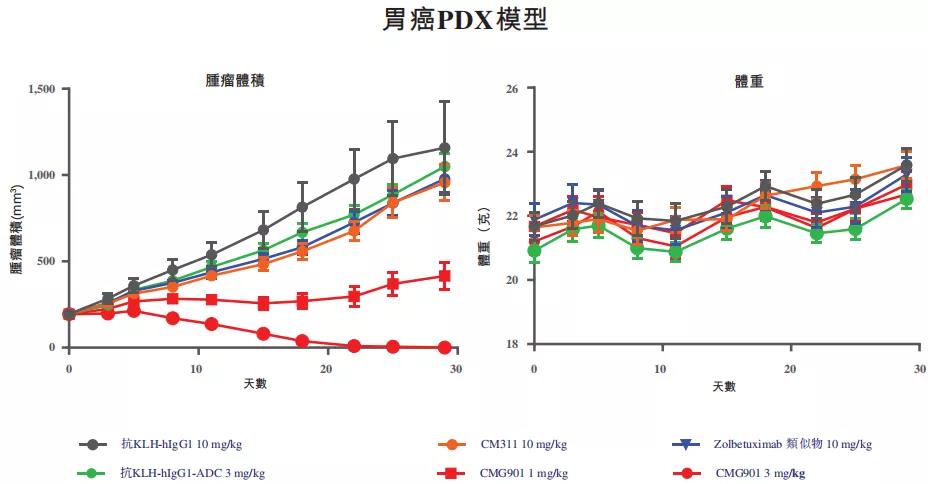
▲CMG901胃癌PDX模型
康诺亚除了着力打造CM310、CM326、CMG901三匹现金牛,还有CM313、MIL-95/CM312、CM338、CM355、CM336五款产品已经进入临床试验阶段,以及CM350、CM352两款正在进行临床前研究。
CM313是中国首款获药监局临床申请批准的国产CD38抗体。在Daudi-Burkitt淋巴瘤CDX模型中,CM313显示出的抗肿瘤活性高于达雷木单抗,在毒性研究中,CM313被证明是一种具有高度特异性且脱靶活性极低的CD38抗体;
MIL95/CM312是一种以CD47为靶点的人源化单克隆抗体,全球尚无已批准的CD47抗体,鉴于在临床前研究中的疗效可观,康诺亚认为CM313有望成为复发╱难治性多发性骨髓瘤、淋巴瘤及其他血液系统恶性肿瘤的创新型治疗选择;
CM338是一种针对MASP-2的高效、人源化拮抗性抗体。全球尚无MASP-2抗体获批,奥麦罗制药的narsoplimab是最领先的MASP-2候选抗体(已向FDA提交BLA),临床前研究表明,CM338远高于narsoplimab类似物的亲和力与MASP-2结合,且大于narsoplimab类似物50倍的效价强度抑制凝集素途径补体激活,2021年11月1日,CM338的获批临床;
康诺亚运用专有nTCE平台开发双特异性抗体,分别为CM355、CM336及CM350。
CM355(CD20xCD3)是治疗复发╱难治性非霍奇金淋巴瘤(NHL)的双特异性抗体,在临床前研究中,相较于主要竞争产品(REGN1979及mosunetuzumab)类似物表现出较强的T细胞依赖性细胞毒性(TDCC)活性,2021年9月16日,CM355开展CD20+B细胞血液瘤的临床试验;
CM336(BCMAxCD3)是治疗多发性骨髓瘤的双特异性抗体,在临床前研究中,CM336对多发性骨髓瘤细胞系的有效抗肿瘤活性方面显示出较高的BCMA亲和力,与其竞争对手再生元的REGN5458类似物类似,且效果远好于杨森的teclistamab类似物;2021年11月21日,康诺亚CM336已获得批准,开展治疗复发或难治性多发性骨髓瘤(RRMM)的临床试验;(《康诺亚:首款双抗报IND!靶向BCMA x CD3!》)
CM350(GPC3xCD3)治疗肝细胞癌的双特异性抗体,在临床前研究中,CM350溶解强效肿瘤细胞的水平优于中外制药╱罗氏的ERY974类似物,与ERY974类似物相比,CM350引起了更强的TDCC,同时具有更佳的安全性。2021年11月9日,康诺亚CM350临床试验申请获CDE受理;(《康诺亚:GPC3 x CD3双抗报IND》)
CM352是一种针对多种实体瘤及血液肿瘤的单克隆抗体,其通过ADCC、CDC及ADCP机制直接破坏癌细胞,并通过阻止骨髓细胞分化及T细胞增殖的特定信号渠道抑制肿瘤生长,CM352目前正在进行临床前安全评估。
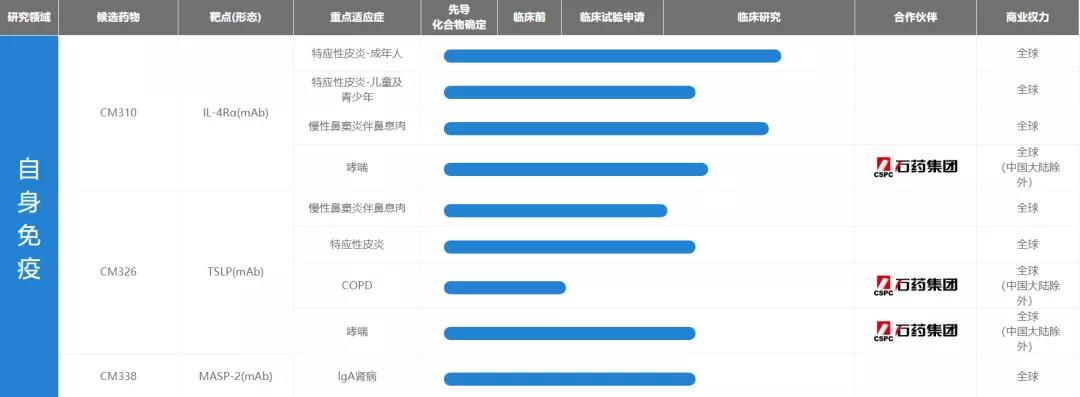

▲康诺亚管线,来源:官网
三、两年亏损近10亿 为何多家明星机构持续加股?
根据招股书说明,2019年公司亏损1.68亿元,2020财年亏损8.19亿元,两年近亏损10亿。与公司连年亏损的情况有所不同,各明星机构纷纷入场。
康诺亚的股东包括众多知名医疗保健投资者,例如联想之星、高瓴资本、Hankang Capital、礼来亚洲基金、Boyu Capital等。

▲主要股东股份及相关股分中的权益及淡仓,来源:2021半年报
首先是康诺亚持续开发抗体疗法,自2016年9月成立至今,其研发能力领先同行。
康诺亚拥有包括10种可进入临床试验申请及临床阶段候选药物在内的产品管线,其中8种候选药物已处于临床阶段,在国产同靶点药物或同类别药物中,有5种候选药物均处于取得中国及╱或美国临床试验申请批准的前三位。
其次是看到不足,以强力的合作提升研发效力,加速重磅药物上市。
康诺亚的核心业务模式是基于差异化或经临床验证的作用机制在内部发现及开发创新疗法,为配合内部研发工作,康诺亚亦通过合资企业或对外授权安排分别与石药、乐普、天广实生物、诺诚健华合作开发项目,具体罗列如下:
2021年3月10日,康诺亚与石药开发和商业化CM310,用于治疗中重度哮喘、慢性阻塞性肺疾病和其他呼吸疾病;2017年10月30日,康诺亚与乐普生物的子公司上海美雅珂就共同开发CMG901,2021年1月11日康诺亚与乐普生物就CMG901合资企业KYM Biosciences Inc;2018年1月,康诺亚与天广实生物合作开发CD47单克隆抗体MIL95/CM312;2017年8月31日,康诺亚与诺诚健华按50:50比例成立合资企业合作开发CM355。
最后是康诺亚拥有行业经验以及科学专业知识丰富的管理团队。
康诺亚由知名的医疗保健投资者支持,由具有远见卓识的领导人陈博博士领导。陈博是一位备受尊敬的科学家,同时也是一位硕果累累的创业企业家。他曾任上海君实(香港联交所:1877╱上交所:688180)的创始人、主席兼行政总裁,领导中国首个获批的国产PD-1抗体特瑞普利单抗(拓益)的开发工作;同时他是广受赞誉的免疫肿瘤学领军专家,曾参与全球首创的PD-1抗体,即百时美施贵宝的nivolumab(Opdivo)的研发。

▲创始人陈博博士,来源:康诺亚官网
康诺亚的管理团队在药物研发、临床开发、CMC及监管事务方面拥有多元化的学科背景及丰富的专业知识。管理团队的其他高级管理成员平均拥有超过20年的行业经验积累,曾于百时美施贵宝、辉瑞及罗氏等跨国大药企参与创新药物开发。
四、生物医药行业加速洗牌 未来如何破局?
作为国内备受瞩目的生物医药公司,康诺亚吃到了医药市场飞速发展与变革的红利。传统靶点竞争紧张,已厮杀惨烈,国外市场厮杀自不必多说,更是红海一片。
随着整个生物医药行业的快速发展,技术日新月异,国内药企也将闻“热”而起,在此情况下,如何更好地采取策略应对竞争,并提高企业效益成为了康诺亚需要思考的重要课题。对此,康诺亚的“解题”如下:
1、整合抗体平台,持续为未获满足的患者提供领先的创新疗法。
在全球药物开发竞争日益激烈的背景下,康诺亚将继续致力于自主发现及开发同类领先的创新候选药物。公司整合的核心平台包括新型T细胞重定向(nTCE)平台、创新抗体发现平台、高通量筛选和生物活性评价平台、高产抗体药物表达细胞平台等,这些平台将持续为未获满足的患者提供领先的创新疗法。
2、加强与PI、KOL及医生合作,快速执行高效且具成本意识的临床开发计划。
康诺亚吸引了众多一级医院及顶级PI加入康诺亚的临床试验。康诺亚认为,与医疗合作者长期的合作关系将对康诺亚大有裨益,事实确实如此,康诺亚的临床阶段候选药物在国产同靶点药物或同类别药物中均处于取得中国及╱美国临床试验申请批准的前三位,同时康诺亚将在未来继续实施高效且具成本意识的临床开发计划,快速将候选药物推向国内外市场。
3、扩大具有成本效益的制造能力,提供可负担的创新生物疗法。
康诺亚的创新疗法可不仅仅针对富裕人群,而更能使普罗大众受益。康诺亚的商业制造能力优异,于2021年在成都天府国际生物城启动生产基地项目建设,预计成为西部最大的创新药物研发及转化中心;于2022年之前全面投入运营额外16,000公升的产能,同时利用高通量筛选平台开发出高表达细胞系,改善生产成本效益。康诺亚将通过增强制造能力突破先前因可负担性约束而形成的市场上限。
截至目前,康诺亚尚未达到商业化,却产生了少量收入,如2019年、2020年通过非主营业务的营收分别为1565万元、4119万元。但在研发开支、行政开支等亏损下,康诺亚仍处于持续亏损状态,2019年、2020年的净亏损分别为1.67亿元、8.19亿元。

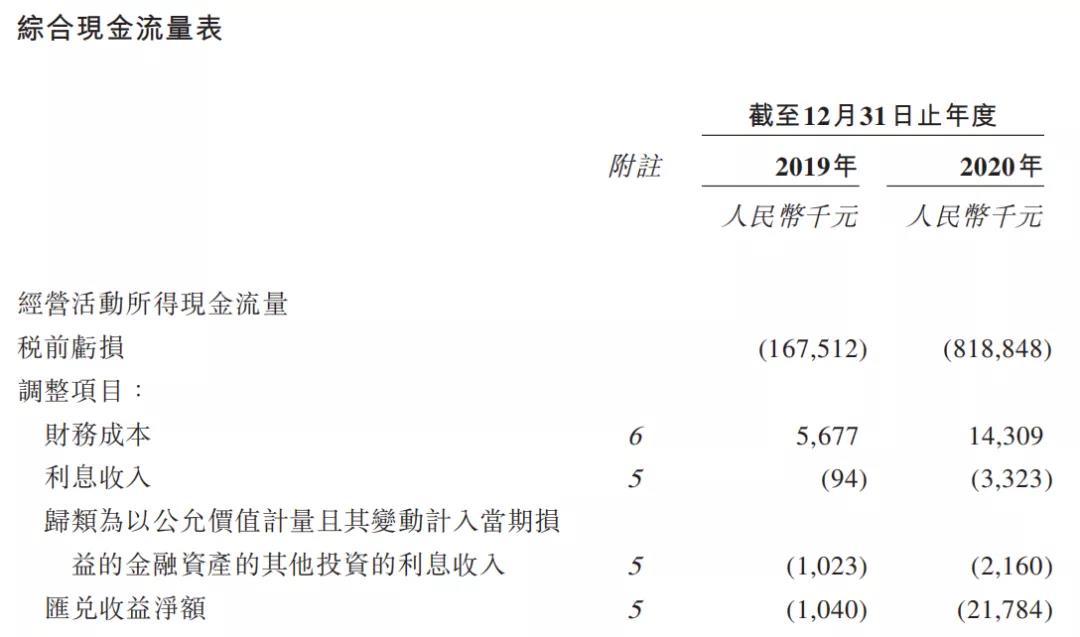
▲2019、2020年财政收入,来源:招股书
康诺亚公司以创新研发为内生动力,研发开支由2019年的人民币64.8百万元增至2020年的人民币127.4百万元,这与康诺亚持续开发候选药物相一致。截至2021上半年,康诺亚的研发开支由2020上半年的39.9百万元增加到191.1百万元,该增加主要是由于雇员薪酬增加人民币109.0百万元、临床试验开支增加人民币22.3百万元及临床前研究开支增加人民币14.2百万元所致。康诺亚未来几年将持续加大研发投入,以支持创新管线日渐丰富的临床研究项目。
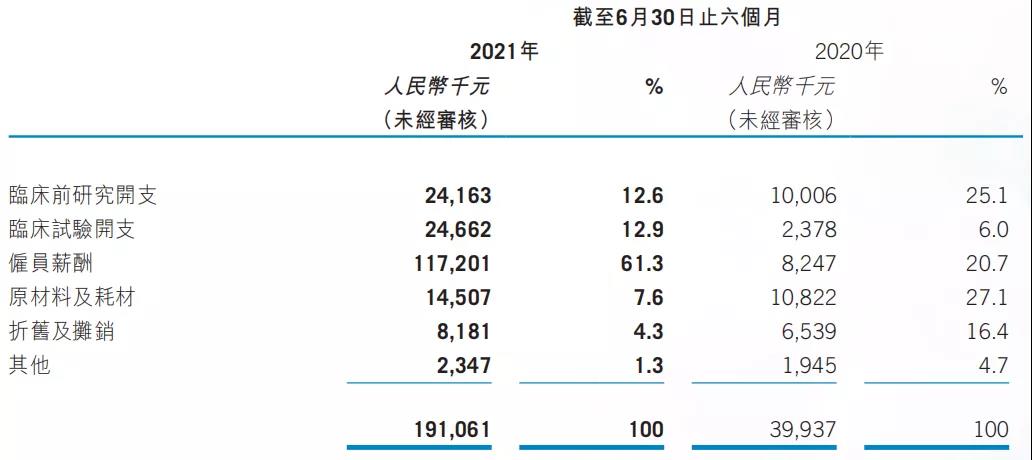
▲2021年上半年研发支出归类,来源:2021上半年财报
总结
针对生物药行业未来演进和发展方向,差异化将是处在急速扩张期的创新药企发展的关键。而体现在具体路径上,是康诺亚通过IL-4Rα抗体CM310、TSLP单抗CM326、MASP-2单抗CM338差异化布局自身免疫领域进入蓝海;通过持续进化的技术平台布局多个成药性靶点药物,多层次满足肿瘤临床需求。总而言之,康诺亚差异化布局自免领域,在多个项目研发上与跨国大企拼速度,并在药物优势上棋高一着,有望成为全球医药行业的大浪淘沙中被留下的“真金”。
参考:
药融云数据:https://www.pharnexcloud.com/;
NMPA/CDE;
FDA/EMA/PMDA;
康诺亚2021上半年财报;
康诺亚招股书;
官网公告;
相关公司披露;
<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论