脂质体纳米粒在临床应用方面取得了极大的成功。无论是已经上市了二十余款小分子给药系统制剂,还是近期RNA疫苗研制中发挥的关键作用,都显示出脂质体在药物应用领域的巨大潜力。该篇综述我们首先对脂质纳米粒及其结构性质关系进行概述,然后聚焦于脂质体纳米粒在临床中的应用。本文为第二部分,概述了影响脂质体性质的结构因素。
本文译自Thai Thanh Hoang Thi和 Nghia P. Truong等人的综述 Lipid-BasedNanoparticles in the Clinic and Clinical Trials: From Cancer Nanomedicine toCOVID-19 Vaccines,Vaccines2021, 9, 359 (2.2.The Properties of Lipid-Based Nanoparticles Governing Their Efficiencies)
2. 脂质纳米粒
2.2. 决定脂质纳米粒传递效率的性质
对于寡核苷酸的递送,纳米颗粒需要包载足量的核酸,并具有特定的组织靶向性。因此,对脂质纳米颗粒的优化是调控药物递送至不同部位的关键。结构决定因素,如粒径、表面电荷、聚乙二醇化和表面修饰的靶向配体,已证明是决定这些纳米颗粒输送效率的关键因素。
小尺寸纳米颗粒已被证明有助于血液和毛细血管中的运输以及组织的摄取。更具体地说,粒径小于10 nm的纳米粒子最适合扩散到毛细血管中,而10~100nm的颗粒更倾向于通过对流被毛细淋巴管吸收。当尺寸为100~200nm时,其快速扩散的能力降低。Oussoren等人的一项研究证明,皮下注射后,40nm脂质体比粒径更大的粒子具有更高的淋巴吸收。这些被注射的40nm脂质体有76%被淋巴结摄取,而较大粒径的脂质体则被保留在皮下注射部位。对于肝靶向,系统给药后,只有100nm的颗粒能够通过肝窗扩散到肝细胞和肝星状细胞。这些结果表明,小尺寸脂质体可增强淋巴结转移能力,并可穿透肝窗以靶向肝细胞。对于大尺寸脂质体(>150nm),这些纳米粒子被注射部位的抗原呈递细胞(APC)吸收,然后被运送到淋巴结。已有研究表明它们在淋巴结内获得了更高的细胞亲和力。
就脂质纳米粒的电荷效应而言,很难得出一般结论。Mai等人报道称,在微血管网络内,阴离子和阳离子脂质体与B细胞的结合程度明显高于不带电荷的脂质体。这一现象可以用类似的阴离子、阳离子脂质体外壳的补体蛋白能够与B细胞相互作用来解释。阳离子脂质体与B细胞受体的相互作用和内化程度最高。阳离子脂质体在血液中被调理素修饰,从而被人体免疫细胞识别。阴离子脂质体主要附着在B细胞表面。这一发现表明,荷电脂质体可能适合于疫苗应用,而中性粒子可能更适合于化疗药物的递送。中村等发现30nm带负电的LNP能够比带正电和中性粒子更有效地靶向淋巴结。结果表明,淋巴结中20~30%的B220+细胞被中性和带正电的LNP标记,而几乎80%的B220+细胞被带负电的LNP标记。与中性和阴离子粒子相比,阳离子粒子在注射部位的保留更为明显。这种效应是由于阳离子LNP和带负电组织之间的高静电相互作用。此外,据报道,阳离子LNP与血浆蛋白非特异性结合,并与较高的免疫原性有关。综上所述,带正电的LNP具有很强的细胞亲和力,但功效有限,而带负电的LNP则能被有效地转运到淋巴结。为了利用这种电荷特性,Hirai等人设计了电荷可逆LNP,这使得其在基因传递方面可以实现两全其美。这些LNP由二棕榈酰磷脂酰胆碱(DPPC)、胆固醇和二油酰甘油磷酸二乙二胺结合物(DOP-DEDA)组成,在pH值为6.0时带正电,在pH值为7.4时带中性,在pH值为8.0时带负电。该系统在血液中是中性的,以最大限度地减少血浆蛋白的降解,并保护包裹的药物。当在血液中循环时,这些DOP-DEDA-LNP载体在其疏水性脂质区域与载脂蛋白(如apoE3)结合,从而促进癌细胞通过网格蛋白和小窝介导的内吞途径摄取它们。在内溶酶体中,pH值较低,这导致DOP-DEDA脂质纳米粒带正电荷,以增强靶细胞中的细胞溶质渗透(图3)。这些具有pH依赖性电荷转化特性的LNP被认为是诱导RNAi介导的基因沉默的安全有效载体。LNPs效力的另一个重要决定因素是脂质pKa。一系列研究表明,pKa为6.4是最大化siRNA LNPs转染的最佳选择。根据mRNA的情况,这种最佳pKa也发生了变化,最佳范围为6.6~6.8。
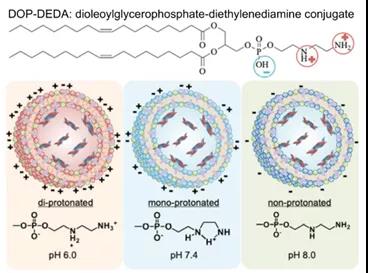
图3pH对质子化的应用及用于包载siRNA的电荷转换脂质体纳米粒的结构
作为一种提高靶向能力的策略,聚乙二醇化的脂质的纳米颗粒获得了极大的研究兴趣,其可以减少血液中颗粒的清除,从而增加其在靶向组织器官的滞留和吸收。Moghimi的研究表明,与裸脂质体相比,PEG修饰阴离子脂质体能够在皮下给药部位获得更好的清除率和在淋巴结中更高的保留率。就PEG长度而言,与较长的PEG修饰脂质体相比,较短的PEG链修饰时能获得较低的清除率,但在淋巴结中的保留率较高。在结构方面,有报道表明,使用线性或支化PEG链可以显著决定LNP的靶向行为和转染能力。Truong课题组用吐温80、吐温20和1,,2-二硬脂酰-sn-甘油-3-磷酸乙醇胺-聚乙二醇(DSPE-PEG)制备的脂质体包载pDNA,并研究其靶向性、稳定性和转染程度。与DSPE-PEG的线性结构相比,Tween20和Tween80这两种非离子表面活性剂均由具有类似支化PEG结构的饱和碳尾制成(图4)。尽管存在这些结构差异,LNP在3周内表现出类似的稳定性。体内转染研究表明,具有较短的PEG的吐温20的颗粒能够更有效地靶向淋巴结。另一方面,具有较长的PEG的吐温80形成靶向脾脏的LNP,但效率较低。带有线性DSPE-PEG的LNP主要在注射部位显示出局部转染。总之,这项研究表明,用支化PEG对LNP进行聚乙二醇化是一种可行的方法,可选择性地有效转染靶器官。据推测,除了分子量和结构外,颗粒上的PEG密度也是一个重要因素。在三种类型的LNP中,带正电的脂质纳米粒的聚乙二醇化与裸纳米粒相比有很大差异。聚乙二醇化可防止带正电的脂质纳米粒在给药部位的高滞留。虽然聚乙二醇化已被证明有助于防止颗粒从体循环中过早清除,但抗聚乙二醇抗体的产生已成为有害的伴随损伤。最近,人们致力于采用具有生物相容性的聚合物的替代策略,以防止在第一次给药后产生抗PEG抗体,否则会导致治疗效果丧失,并可能对后续剂量产生不利影响。同时,Chen等人发现,在脂质纳米粒中加入4mol%地塞米松能够抑制注射后的免疫反应和抗体产生,这可能有助于开发聚乙二醇化脂质纳米粒载体。
除了依赖于长时间循环和细胞被动摄取纳米颗粒外,制剂科学家已经认识到,通过将受体配体结合到颗粒表面,可以增强对靶细胞的摄取。用靶向配体修饰脂质纳米粒是有效地将给药系统靶向淋巴结或其他所需组织细胞的关键策略。例如,Vu等人使用血凝素抗原(HA)将脂质体表面功能化,以提高抗体产生效率。这项工作表明HA功能化脂质体能够穿过淋巴结中的屏障细胞,增强生发中心的形成和卵泡辅助性T细胞免疫。通过共价键极将单克隆抗体(MABs)结合到纳米颗粒表面,进而靶向白细胞,也是一种有希望的途径。Veiga等人将抗Ly6C抗体与载有siRNA的脂质纳米粒结合,形成ASSET平台(锚定二级单链抗体实现靶向性,AnchoredSecondary scFv Enabling Targeting)。如其他研究所示,该制剂能够在体内选择性地靶向炎症白细胞。同样,实体瘤的p32表达水平通常高于非癌组织。为了利用这一点,已经开发出linTT1(AKRGARSTA)和LyP-1肽,它们能够以强亲和力与p32结合。因此,这些肽被用作肿瘤归巢的靶向配体。事实上,亨特等人将linTT1用作腹膜癌病的靶向配体,发现这些纳米颗粒在小鼠腹膜肿瘤中的吸收程度比非靶向颗粒更大。Slik等人在体内外研究中还证明了使用linTT1作为配体的肿瘤靶向显示出类似的结果。对于神经系统疾病的治疗,以神经系统为靶点是必要的。Kuo等人设计了一种被Ln5-P4(PPFLMLLKGSTR)肽(Ln5-P4-ASLNs)的修饰的两亲性固体脂质纳米粒的处方,用于共同输送神经生长因子(NGF)和维甲酸(RA)。Ln5-P4结合α3β1整合素,支持细胞粘附和扩散,引导诱导的多能干细胞向神经元分化。该制剂被证明可以提高诱导多能干细胞的存活率和成熟神经元的生成,可作为再生医学中神经退行性疾病和神经损伤的潜在治疗方法。在其他研究中,通过将狂犬病病毒糖蛋白(RVG)肽(狂犬病病毒糖蛋白的一个片段)附着在包载siRNA的囊泡表面,提高了对神经细胞的选择性。该制剂在阿尔茨海默病小鼠模型中显示出积极作用。为了增强树突状细胞的细胞摄取以增强免疫反应,脂质纳米粒已与细胞穿透肽(如R8和GALA)结合。树突状细胞受体和肝细胞的许多其他配体已开发用于靶向目的。融合肽(如DOPE)也能改善膜融合,从而提高细胞摄取。转铁蛋白、叶酸和抗体可以用作脂质纳米粒的配体,以靶向癌细胞受体。为了提高siRNA转染率,将Niemann-Pick型C-1蛋白(NPC-1)抑制剂NP3.47与脂质纳米粒表面结合。NP3.47促进了siRNALNPs在晚期内体溶酶体中的积累,比未修饰的脂质纳米粒高出3倍。由于NP3.47-LNP-siRNA纳米粒在晚期溶酶体中的捕获增加,这可以增加其从溶酶体中逃逸的机会,从而实现siRNA和其他寡核苷酸的传递。
近年来,脂质纳米粒已成为将药物递送至靶细胞的最有效载体,并已在临床上取得成功。在此之前,已有综述对分析表征、基本技术概念和要点详尽的总结。本篇综述将集中于脂质纳米粒在临床上的应用。
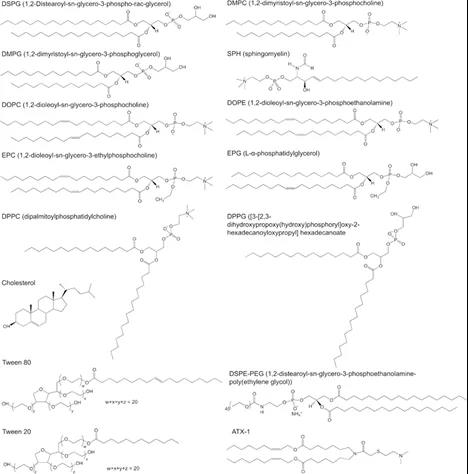
图4. 靶向脂质体的
参考阅读
临床应用和临床试验中的脂质体纳米粒(一):脂质体概述
<END>

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论