上个世纪初,免疫学之父保罗·埃利希(Paul Ehrlich)提出通过单克隆抗体“haptophore”靶向癌细胞输送细胞毒性药物“toxophore”来治疗癌症,形成了世界上最早的抗体偶联药物(Antibody-drug conjugates, ADC)概念。ADC药物是采用特定的连接子将抗体和小分子细胞毒药物连接起来,其主要组成成分包括抗体(antibody)、连接子(linker)和小分子细胞毒性药物(small molecular cytotoxic drug, SM)。因其可以精准治疗癌症,ADC也被称为“魔法子弹”。

ADC药物结构示意 图源:维基百科
2000年,由辉瑞开发的首个ADC药物Mylotarg(Gemtuzumab ozogamicin,吉妥单抗)获批上市,但当时ADC药物并未在全球医药界激起很大的浪花。并且由于Mylotarg在一项III期临床试验中出现的毒副作用和疗效缺乏情况,该药物于2010年黯然撤市,后又以更低的分级剂量重新上市。
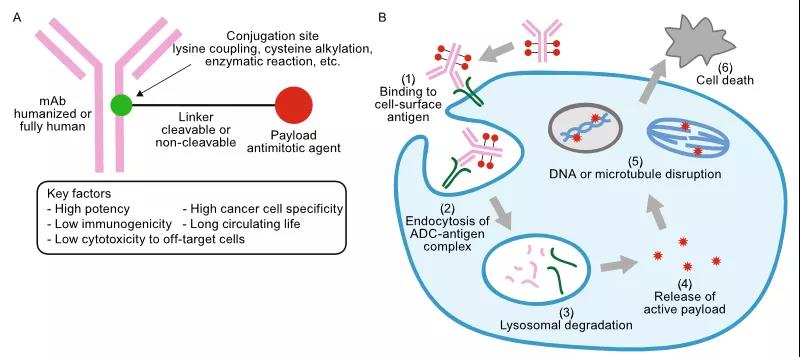
ADC药物作用机制 图源:Protein & Cell (DOI:10.1007/s13238-016-0323-0)
第二款上市的ADC药物为Adcetris(brentuximab vedotin,维布妥昔单抗),由Seagen(曾名为Seattle Genetics)与千禧制药(2008年被武田制药收购)合作开发,该药于2011年加速获批上市,是第一个特定用于间变性大细胞淋巴瘤的新药,也是近40年来美国FDA批准的第一个难治性霍奇金淋巴瘤的一线用药,成为了重新定义CD30阳性淋巴瘤治疗的标杆产品。罗氏的Mylotarg(Gemtuzumab ozogamicin,吉妥单抗)撤市之后,Adcetris的获批不仅提升了ADC药物研发的信心,还实现了弯道超车,迅速占领ADC药物市场。截至2021年7月29日,该药已在全球76个国家上市。

Adcetris 图源:Seagen
由于药物研发通常需要大量时间和金钱投入,小公司通常难以与行业巨头进行竞争,作为ADC药物领域最引人注目的公司之一,Seagen却只有20多年的历史,甚至比某些药物研发的时间还要短,不仅如此,Adcetris(brentuximab vedotin,维布妥昔单抗)还是Seagen开发的第一个药物,该公司的研发水平可见一斑。
关于Seagen
Seagen(西雅图基因)是一家全球性生物技术公司,致力于发现、开发和商业化针对癌症的变革性药物,为人们的生活带来有意义的改变,该公司是抗体偶联药物(ADCs)领域的行业领导者。
1998年,曾在百时美施贵宝(Bristol-Myers Squibb)工作了6年之久的Clay B. Siegall博士与合作伙伴创立了Seagen公司,总部设立于美国华盛顿特区,当时公司的名字还是Seattle Genetics(西雅图遗传学)。2001年,Seattle Genetics在美国纳斯达克上市,募得4900万美元。2020年10月8日,Seattle Genetics宣布将公司名称改为Seagen,更名反映了Seagen摆脱地域限制,迈向全球的雄心壮志。

Seagen目前有三款已上市药物:
Adcetris(brentuximab vedotin,维布妥昔单抗)是Seagen与武田制药共同开发的靶向CD30抗原的抗体偶联药物,已在70多个国家获批用于治疗CD30阳性的特定类型淋巴瘤患者。并且该药物正在开展针对霍奇金淋巴瘤和其他CD30阳性癌症的临床试验。药融云全球上市数据(www.pharnexcloud.com)显示,该药物于2020年5月12日获得中国国家药品监督管理局(NMPA)的正式批准,用于治疗复发性或难治性系统性间变性大细胞淋巴瘤(sALCL)或CD30阳性霍奇金淋巴瘤患者,中文商品名为安适利。
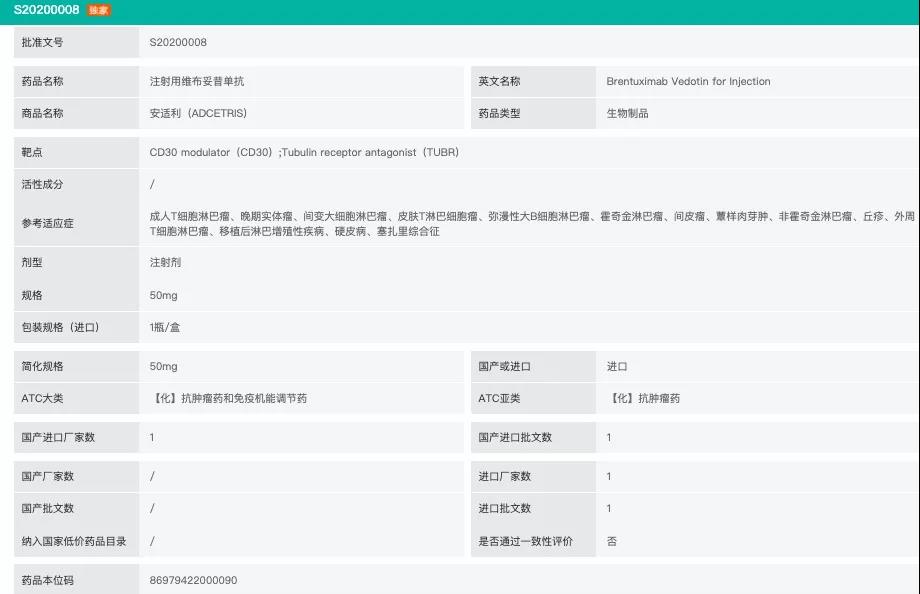
来源:药融云数据库
Padcev(enfortumab vedotin-ejfv)是抗Nectin-4单克隆抗体与微管抑制剂偶联的抗体偶联药物,Nectin-4蛋白是在尿路上皮癌中高度表达的细胞粘附分子。该药物由Seagen与安斯泰来合作开发,药融云全球上市数据(www.pharnexcloud.com)显示,该药物曾获得美国食品和药物管理局(FDA)授予的突破性疗法认定和优先审评资格,2019年12月18日,FDA批准Padcev(enfortumab vedotin-ejfv)上市,用于治疗曾经接受过含铂化疗和PD-1/PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌患者。
Tukysa(Tucatinib,图卡替尼)是一种靶向HER2的口服小分子酪氨酸激酶抑制剂(TKI),由Seagen与默沙东合作开发。2020年4月17日,美国食品药品监督管理局(FDA)批准了Tukysa联合曲妥珠单抗(Herceptin)和卡培他滨(Xeloda)用于治疗局部晚期无法切除或转移性HER2阳性乳腺癌患者(包括脑转移患者)。该药物曾获得FDA快速通道和突破性药物资格。
2020财年业绩
2021年2月11日,Seagen公布其2020财年业绩。根据财报,公司2020财年(2019年1月1日至2020年12月31日)总收入达21.76亿美元(+137.32%),其中产品销售总额为10亿美元(+59.24%);特许权使用费收入为1.27亿美元(-8.45%);合作和许可协议收入高达10.48亿美元(+597.87%),这部分收入大幅增长,主要是由于2020年9月14日,Seagen与默沙东宣布达成协议,双方将共同开发和商业化Seagen的靶向LIV-1的新型在研ADC药物Ladiratuzumab Vedotin(LV),Seagen还授予默沙东独家许可,在亚洲、中东和拉丁美洲以及其他地区(美国、加拿大和欧洲除外)开展Tukysa(Tucatinib,图卡替尼)的商业化工作。此外,默沙东还宣布购入Seagen公司价值10亿美元的普通股股权。当日,Seagen股票涨幅达14.55%。

图源:雪球
2020年,Seagen全年净利润达6.14亿美元,调整后每股净收益为3370美元。
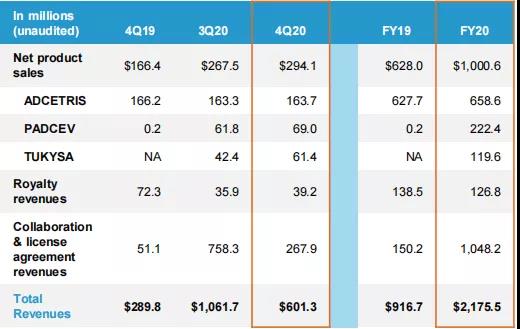
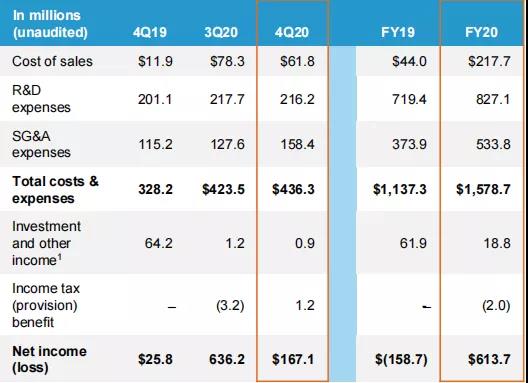
图源:Seagen产品业绩与简单财务 (由于采用四舍五入,金额可能无法进行合计)
其中,Adcetris(brentuximab vedotin,维布妥昔单抗)的全年销售业绩为6.59亿美元,同比增长4.92%,分季度来看,该药物的销售业绩趋向平稳,公司表示可能是因为新冠疫情的影响,导致医生对霍奇金淋巴瘤(HL)患者的诊断量减少,但市场份额仍然保持不变;Padcev(enfortumab vedotin-ejfv)于2019年底上市,2020年销售业绩为2.22亿美元,表现出了良好的市场渗透率,公司预计该药物销售业绩将于2021年实现新一轮增长;Tukysa(Tucatinib,图卡替尼)于2020年4月上市,上市当月即取得了不错的销售业绩,2020全年销售业绩为1.20亿美元。公司表示,这得益于有利的指导方针,快速的审批流程,以及优秀的营销策略和良好的患者适应性。
2021年上半年业绩
2021年Q1
2021年4月29日,Seagen披露了2021财年第一季度(2021年1月1日至2021年3月31日)业绩,根据季报,公司第一季度总收入达3.32亿美元(+41.56%),其中产品销售总额为3.03亿美元(+52.43%);特许权使用费收入为2721.9万美元(+33.69%);合作和许可协议收入为217.6万美元(-86.09%)。第一季度净利润为-1.21亿美元,调整后每股净亏损670美元。

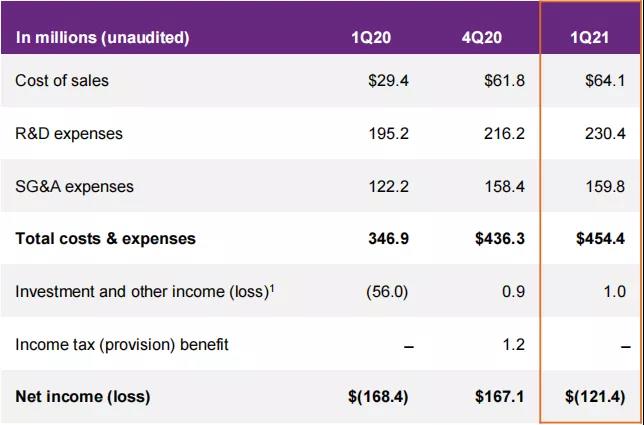
图源:Seagen (注:由于采用四舍五入,金额可能无法进行合计)
其中,Adcetris(brentuximab vedotin,维布妥昔单抗)第一季度销售业绩为1.63亿美元,同比减少0.90%,与去年同期大致持平;Padcev(enfortumab vedotin-ejfv)的销售业绩为6975.8万美元,同比增长102.43%,实现了高市场渗透率,并如公司预期,开始新一轮增长;Tukysa(Tucatinib,图卡替尼)业绩为7025.7万美元,开始持续放量,该药在HER2阳性乳腺癌患者中的使用快速增长,成为美国二线治疗HER2阳性乳腺癌脑转移患者使用最广泛的药物,并已获欧盟批准,在法国和德国上市,进一步拓展欧洲市场。
2021年Q2
2021年7月29日,Seagen披露了2021财年第二季度(2021年4月1日至2021年6月30日)业绩,公司第二季度总收入为3.89亿美元(+44%),其中产品销售总额为3.47亿美元(+44%);特许权使用费收入为3629.6万美元(+16.2%);合作和许可协议收入为484.4万美元(-23.09%)。
加上第一季度,Seagen在2021年上半年总收入达7.20亿美元,同比增长40.57%;产品销售总额达到6.5亿美元,同比猛增48%;特许权使用费收入为6351.4万美元,同比增长23.1%;合作和许可协议收入为702万美元,同比减少68%。

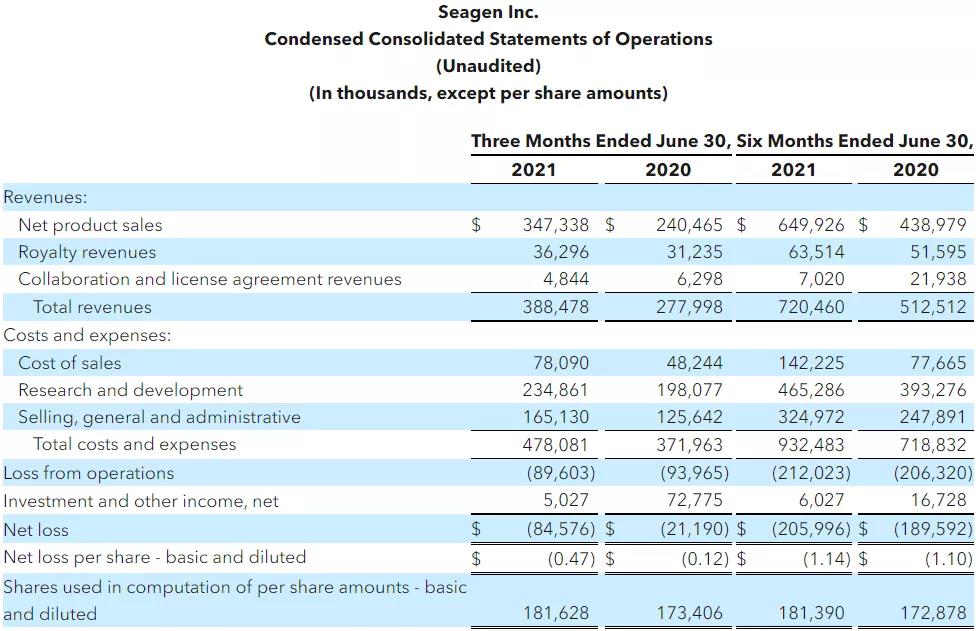
图源:Seagen (注:由于采用四舍五入,金额可能无法进行合计)
第二季度产品业绩增长强劲,三款已上市产品均创下了新的季度销售业绩纪录,2021年上半年取得了显著的业绩增长。其中,Adcetris(brentuximab vedotin,维布妥昔单抗)第二季度销售业绩为1.82亿美元,同比增长9%,上半年收入达3.45亿美元,同比增长4%;Padcev(enfortumab vedotin-ejfv)第二季度销售业绩为8240万美元,同比增长44%,上半年收入达1.52亿美元,同比增长66%;Tukysa(Tucatinib,图卡替尼)第二季度销售业绩为8300万美元,同比增长427%,上半年收入达1.53亿美元,同比增长873%。
按季度分,近期三款上市产品销售业绩趋势如下:

图源:Seagen
据悉,Seagen自成立之时就伴随其研发进程,保持着相当数量的高质量专利申请,围绕其核心技术打造了多层次的专利保护池。在ADC药物中,Seagen的核心竞争力有小分子细胞毒性药物等。因为针对某个具体靶点,可以对应多个不同的单克隆抗体,而且各国对于抗体类专利的保护范围往往较小,而对于小分子细胞毒性药物,由于化合物专利的保护范围相对较宽,而且目前已知能够用于ADC的小分子毒物选择范围很窄,因此Seagen一旦成功申请小分子细胞毒性药物的专利,将使得其他企业不得不向其支付专利许可费,以换取这些小分子细胞毒性药物的使用权。
所以Seagen的主要收入除了来自于公司产品的销售,其特许权使用费收入、合作和许可协议收入也占了相当一部分。新药研发投入大,周期长,Seagen的第一款产品在公司成立13年后才得以上市,在这之前,其就已通过专利许可费获得了大量现金收入,从而得以支撑众多在研新药的巨额支出。不过随着2019年底和2020年上市了两款新产品,公司的产品业绩实现了新的增长,未来将会有越来越多的产品上市,有望继续降低公司对专利许可费用的依赖性。

图源:Seagen
技术平台&研发管线
据药融云数据(www.pharnexcloud.com)以及Seagen官方披露,截至2021年7月29日,公司共有11款潜在新药在研,以及3款已上市药物正在积极拓展适应症。利用其强大的抗体偶联药物(ADC)技术平台以及糖工程化抗体(SEA)平台,致力于开发新一代靶向疗法,以推进癌症护理,并专注于有潜力满足重大医疗需求的疗法,公司正在持续拓展并推进其在实体瘤和恶性血液肿瘤领域的研发管线。
作为ADC药物行业领导者,Seagen依托其自有ADC技术平台,识别并设计特异性抗体,精准靶向肿瘤表达的抗原;开发新型高度特异性ADC连接子,将小分子细胞毒性药物有效荷载于抗体,在体循环中保持稳定,并限制脱靶毒性;同时开发新型小分子细胞毒性药物,诱导抗肿瘤免疫反应。
其SEA技术平台通过在2-氟岩藻糖条件下培养抗体形成细胞,阻断细胞岩藻糖基化途径,产生一种能与先天免疫细胞上的激活受体结合更紧密的非岩藻糖基化抗体,增加受体交联,提高抗体依赖性细胞毒性,增强抗肿瘤免疫反应。

图源:Seagen(更新至2021年7月29日)
所有在研项目中,除了已上市的3款药物,还包括Seagen与丹麦生物制药公司Genmab联合开发的组织因子(TF)靶向药物Tisotumab vedotin,以及与默沙东合作开发的LIV-1靶向药物Ladiratuzumab vedotin值得关注。此外,还有7款处于临床1期的候选药物,以及2款处于临床前研究的潜在ADC药物。
3款已上市药物
三款已上市药物正在积极拓展适应症,扩大全球影响力。其中,Seagen正在拓展Adcetris(brentuximab vedotin,维布妥昔单抗)应用于淋巴瘤与实体瘤的潜力,该药与来那度胺(lenalidomide)和利妥昔单抗(Rituximab)联合用药治疗复发性或难治性弥漫性大B细胞淋巴瘤的研究已进入3期临床试验。Adcetris单药一线治疗不适用于联合化疗的霍奇金淋巴瘤(HL)或外周T细胞淋巴瘤(PTCL)的研究已进入2期临床试验。此外,Seagen正在开展探索性试验,研究Adcetris与Keytruda(pembrolizumab,帕博利珠单抗[可瑞达])联用治疗经PD(L)-1抑制剂治疗仍然进展的转移性实体瘤,且已进入2期临床试验。
Padcev(enfortumab vedotin-ejfv)正在广泛拓展其应用于尿路上皮癌的潜力,该药与Keytruda(pembrolizumab,帕博利珠单抗[可瑞达])联用一线治疗局部晚期或转移性尿路上皮癌的研究已进入3期临床试验,该联合疗法用于治疗肌层浸润性膀胱癌的研究也已进入3期临床试验。此外,Padcev单药治疗局部晚期或转移性实体肿瘤的研究已进入2期临床试验。
2021年7月9日,Seagen宣布FDA已授予Padcev常规批准并批准其扩大适应症,用于治疗既往接受过PD(L)-1抑制剂治疗且不符合顺铂治疗条件的局部晚期或转移性尿路上皮癌患者。据悉,Padcev是首款也是目前唯一一款被FDA批准,用于治疗既往接受过免疫治疗且不符合顺铂治疗条件的局部晚期或转移性尿路上皮癌患者的药物。
此次常规批准基于一项名为EV-301的3期临床试验,该研究在以往接受过铂类化疗和一种PD-1/L1抑制剂治疗的局部晚期或转移性尿路上皮癌患者中比较了Padcev(enfortumab vedotin-ejfv)与化疗的疗效,结果显示,中位随访期11.1个月,与化疗组相比,Padcev组中位总生存期显著延长(mOS:12.9个月 v.s. 9.0个月;HR=0.70;95%CI:0.56,0.89;p=0.0014)、中位无进展生存期显著延长(mPFS:5.55个月 v.s. 3.71个月;HR=0.62;p<0.001),研究结果发表于《新英格兰医学杂志》(DOI: 10.1056/NEJMoa2035807)。
扩大适应症的批准基于一项名为EV-201的关键2期临床试验队列2的结果,队列2为先前接受过一种PD-1/L1抑制剂治疗、未接受过含铂化疗且不符合顺铂化疗条件的局部晚期或转移性尿路上皮癌患者。结果显示,中位随访时间为16个月,接受Padcev治疗的患者中,已证实的客观缓解率(ORR)为51%(95%CI:39.8,61.3),其中完全缓解率(CR)为22%;中位缓解持续时间(mDOR)为13.8个月(95% CI: 6.4, NE),中位无进展生存期(mPFS)和中位总生存期(mOS)分别为6.7个月(95% CI:5.0-8.3)和16.1个月(95% CI: 11.3, 24.1)。

Tukysa(Tucatinib,图卡替尼)正在被开发用于治疗HER2阳性乳腺癌以及消化道癌症等。该药用于一线或二线治疗转移性HER2阳性乳腺癌的研究已进入3期临床试验。同时,Seagen正在与美国国家癌症研究所(NCI)和肿瘤临床试验联盟联合研究Tukysa用于治疗早期高危型HER2阳性乳腺癌,且已进入3期临床试验。Tukysa联合曲妥珠单抗(Trastuzumab[赫赛汀])用于治疗复发或难治性转移性HER2阳性结直肠癌的研究已进入2期临床试验,该药与曲妥珠单抗、雷莫芦单抗(Ramucirumab)以及化疗联合治疗HER2阳性胃食管癌的研究也已进入2期临床试验。
2021年6月3日,Seagen公布了在接受曲妥珠单抗(Trastuzumab)和卡培他滨(Capecitabine)联合治疗的HER2阳性转移性乳腺癌(MBC)伴或不伴脑转移患者中,加入Tukysa(Tucatinib,图卡替尼)的关键HER2CLIMB试验的长期随访数据。在继续随访15.6个月(总计29.6个月)后,Tukysa组mOS延长了5.5个月,曲妥珠单抗+卡培他滨+Tukysa疗法mOS为24.7个月(95% CI: 21.6,28.9) v.s. 卡培他滨+曲妥珠单抗疗法mOS为19.2个月(95% CI: 16.4,21.4);Tukysa组mPFS也得到了延长,曲妥珠单抗+卡培他滨+Tukysa疗法mPFS为7.6个月(95% CI: 6.9,8.3) v.s. 卡培他滨+曲妥珠单抗疗法mPFS为4.9个月(95% CI: 4.1,5.6)。

3款处于开发后期的药物
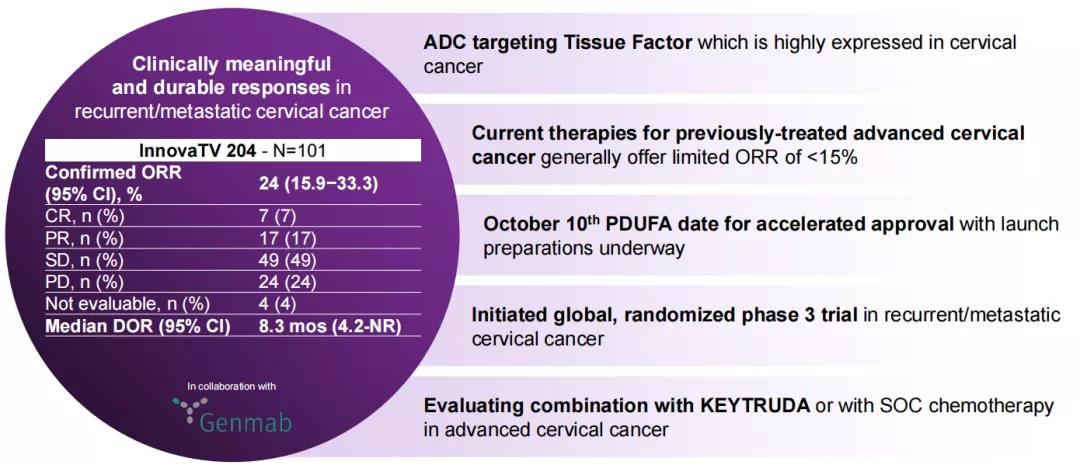
2021年4月9日,Seagen与Genmab A/S联合宣布,FDA已受理了双方提交的生物制品许可申请(BLA),该BLA寻求加速批准双方共同开发的抗体偶联药物(ADC)Tisotumab Vedotin(TV),用于治疗在化疗期间或化疗后病情进展的复发性或转移性宫颈癌患者,并授予了优先审查资格,PDUFA日期为2021年10月10日,预计该药将成为Seagen第四款获批上市的药物。该药物结合了Genmab的组织因子(TF)靶向单抗tisotumab以及Seagen的ADC技术,靶向癌细胞上的TF抗原,并将细胞毒制剂MMAE(monomethyl auristatin E,单甲基奥瑞他汀E)直接递送至癌细胞内。Seagen表示,该药是潜在的“first-in-class”宫颈癌ADC药物。同时,双方正在开展该药作为单药疗法或联合疗法治疗宫颈癌、卵巢癌以及其他实体瘤的研究。
Ladiratuzumab Vedotin(LV)是一种靶向LIV-1蛋白的ADC药物,LIV-1在大多数转移性乳腺癌、肺癌、头颈癌、食管癌和胃癌等均有表达。2020年9月,Seagen与默沙东达成协议,双方将共同进行Ladiratuzumab Vedotin的开发和商业化工作。目前,双方正在开展该药与Keytruda(pembrolizumab,帕博利珠单抗[可瑞达])作为一线疗法联合治疗三阴性乳腺癌的研究。此外,LV单药治疗复发或难治性转移性实体瘤以及转移性乳腺癌的研究也分别进入2期和1期临床试验。
2021年8月8日,Seagen与荣昌生物(09995.HK)达成一项全球独家许可协议,以开发和商业化其HER2-ADC新药维迪西妥单抗。据悉,荣昌生物从此次交易中获得的潜在收入总额将高达26亿美元,包括2亿美元首付款和最高可达24亿美元的里程碑付款,同时,荣昌生物将获得维迪西妥单抗在Seagen区域净销售额从高个位数到百分之十几的梯度销售提成。Seagen获得维迪西妥单抗在荣昌生物区域以外的全球开发和商业化权益,荣昌生物将保留在亚洲区(除日本、新加坡外)进行临床开发和商业化的权利。这一交易数额刷新了中国制药企业单品种海外授权交易的最高纪录。
早期潜在候选新药
此外,Seagen还在2021年美国癌症协会年会(AACR 2021)上介绍了几款早期肿瘤学项目。SGN-STNV是一款靶向Sialyl Thomsen-nouveau(STn)的ADC药物,STn是一种肿瘤相关的碳水化合物抗原(TACA),在多种癌症如乳腺癌、卵巢癌和结肠癌中过度表达。早期实体瘤研究模型显示该药物具有与其他类似ADC药物相当的抗肿瘤活性;SGN-B6A是一款靶向整合素β的新型ADC药物,已在针对非小细胞肺癌的临床前研究中显示出广泛的抗肿瘤活性,并在整合素β高表达模型中显示出最佳反应;SEA-TGT是一款靶向TIGIT的单克隆抗体,TIGIT在肿瘤浸润淋巴细胞中常处于高表达水平,该药物单药或与抗PD-1抗体联用均表现出抗肿瘤活性和治疗效果。
除此之外,SEA-CD40是Seagen利用其专有的糖工程化抗体(SEA)技术,开发的首个靶向CD40的非岩藻糖基化单克隆抗体,临床前研究显示,SEA-CD40可靶向激活CD40信号通路,增强免疫系统抗肿瘤活性,目前正处于1期临床试验,适应证包含霍奇金淋巴瘤,晚期实体肿瘤,胰腺癌等;SEA-BCMA是一款靶向B细胞成熟抗原(BCMA)的非岩藻糖基化抗体,BCMA是多发性骨髓瘤(MM)细胞系上极具选择性表达的受体,SEA-BCMA在临床前模型中显示出了富有前景的抗骨髓瘤活性,目前正在开展针对复发或耐药性多发性骨髓瘤的1期临床试验;SEA-CD70是一款靶向CD70的研究性非岩藻糖基化单克隆抗体,CD70属于肿瘤坏死因子(TNF)超家族成员之一,在多种肿瘤细胞中呈现高表达,目前SEA-CD70正在开展1期临床试验,评估该药针对骨髓增生异常综合征(MDS)和急性髓细胞性白血病(AML)患者的安全性、耐受性、药代动力学以及抗肿瘤活性。2019年11月,百济神州获得了SEA-CD70在亚洲(除日本)以及部分其他地区开发SEA-CD70的权利,2021年6月11日,百济神州SEA-CD70的临床试验申请获CDE批准(受理号:JXSL2101005),成为国内首款获批临床的CD70单抗。
主要发展历史
1998年,Seattle Genetics成立于美国华盛顿州。
1999年,Seattle Genetics开始研究抗CD30抗体。
2000年,Seattle Genetics的研究人员合成了一甲基澳瑞他汀E(MMAE),是公司第一款抗体偶联药物(ADC)brentuximab vedotin(Adcetris)所荷载的细胞毒性药物。
2007年,Seattle Genetics和Agensys(后被安斯泰来收购)达成合作,共同开发enfortumab vedotin(Padcev),一种靶向Nectin-4的ADC药物。
2009年,Seattle Genetics和武田制药宣布在全球范围内,共同开发和商业化Adcetris(brentuximab vedotin)。
2011年,Adcetris(brentuximab vedotin)在美国被批准用于治疗复发性霍奇金淋巴瘤(cHL)和复发性系统性间变性大细胞淋巴瘤(ALCL)。
2016年,Seattle Genetics欧洲总部在瑞士楚格成立。
2018年,Seattle Genetics收购了美国临床阶段生物制药公司Cascadian Therapeutics,获其后期研究药物HER2高选择性口服小分子激酶抑制剂Tucatinib。
2019年,Padcev(enfortumab vedotin-ejfv)在美国获批治疗曾经接受过铂基化疗和PD-1/PD-L1抑制剂治疗的局部晚期或转移性尿路上皮癌患者。
2020年,FDA批准了Tukysa(Tucatinib,图卡替尼)联合曲妥珠单抗(Herceptin)和卡培他滨(Xeloda)用于治疗局部晚期无法切除或转移性HER2阳性乳腺癌患者。10月,Seattle Genetics宣布更名为Seagen,反映了Seagen摆脱地域限制,迈向全球的雄心壮志。
结 语
Seagen创始人Clay Siegall博士的经历给公司留下了深刻的烙印,他的父亲曾被诊断出患有脑癌,经历了手术、化疗、放疗等一系列治疗,也没能拯救他父亲的生命。这段经历促使Siegall先后在美国国立卫生研究院和制药巨头BMS进行癌症研究,并在1998年创立了Seagen。Siegall曾表示,创立Seagen“不只是我的事业,也是我的使命”。如今,这家曾经资金短缺的创业型公司已成为ADC领域公认的先行者。虽然公司目前没有实现持续的盈利,但其在研发领域的持续投入赋予公司不断实现突破的潜力。同时,Seagen也积极与其他制药公司开展合作,开发创新药物。相信其摆脱地域限制,迈向全球的雄心壮志将为更多患者带来改写生命的疗法。







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论