1.1.1 总体概况
根据摩熵医药数据统计,2024.09.16-2024.09.22期间共有34个创新药/改良型新药临床申请/上市申请获国家药品监督管理局药品审评中心(CDE)承办(按受理号统计,不含补充申请)。其中,国产药品受理号25个,进口药品受理号9个。
本周共计49款创新药/改良型新药临床试验申请获得“默示许可”,包括化学药31款,生物药17款,中药1款。其中值得注意的有:
(1)CB03-154片
9月18日,CDE官网公示:挚盟医药的CB03-154片获得临床试验默示许可,用于治疗成人肌萎缩侧索硬化(又称“渐冻症”、“ALS”)。公开资料显示,CB03-154片是一款新一代KCNQ2/3钾离子通道开放剂,具有较好的离子通道选择性、化学和代谢稳定性、抗神经过度兴奋等活性和药效、药代性质及安全性,已获得美国食品药品监督管理局授予的孤儿药资格认证。
(2)CSL300
9月18日,CDE官网公示:CSL Behring的CSL300 (Clazakizumab)获得临床试验默示许可,用于降低有系统性炎症证据并且患有动脉粥样硬化性心血管疾病(ASCVD)或糖尿病(DM)的接受维持性透析的成人患者的心血管(CV)死亡和心肌梗死(MI)风险。公开资料显示,CSL300(Clazakizumab)是一种靶向白细胞介素-6(IL-6)配体的单克隆抗体。
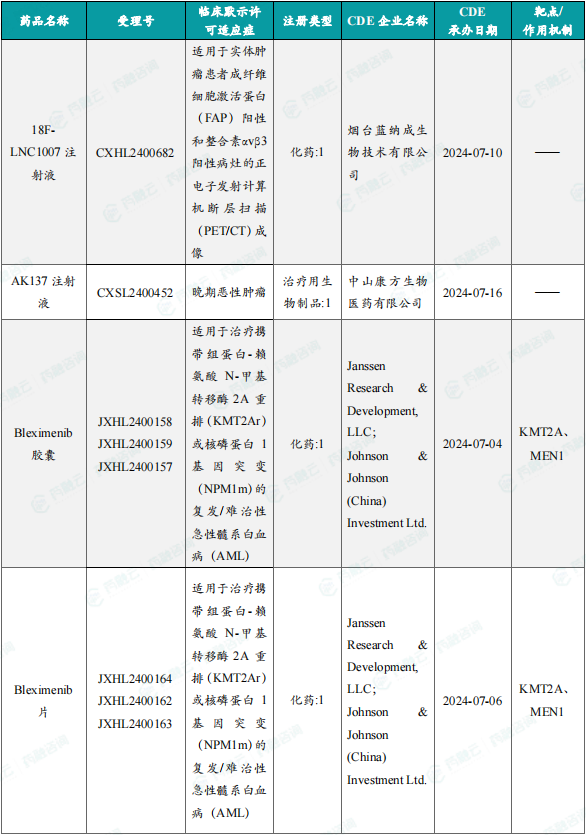
(3)Bleximenib胶囊
9月19日,CDE官网公示:强生(Johnson&Johnson)的Bleximenib胶囊获得临床试验默示许可,用于治疗携带组蛋白-赖氨酸N-甲基转移酶2A 重排(KMT2Ar)或核磷蛋白1基因突变(NPM1m)的复发/难治性急性髓系白血病(AML)成人患者。公开资料显示,bleximenib是一款Menin-KMT2A相互作用抑制剂。
(4)18F-LNC1007注射液
9月20日,CDE官网公示:蓝纳成的18F-LNC1007注射液获得临床试验默示许可用于实体肿瘤患者成纤维细胞激活蛋白(FAP)阳性和整合素αvβ3阳性病灶的正电子发射计算机断层扫描(PET/CT)成像。公开资料显示,18F-LNC1007注射液是一种新型双靶点放射性体内诊断药物,同时靶向成纤维细胞活化蛋白(Fibroblast Activation Protein)和整合素αvβ3 (Integrin αvβ3)。
本周无新药获批上市。
1.1.2 本周获批临床创新药/改良型新药信息速览(不含补充申请)






备注:(1)此处未包括补充申请之情形;(2)此处所列创新药/改良型新药,主要是指CDE受理批准的1类、2类、5.1类以及生物制品3.1类和3.2类。(3)更多获批临床信息及研发进展详情及相关靶点全局分析等,可通过摩熵医药中国药品审评数据库获取并下载EXCEL表格。
1.1.3 本周获批上市创新药信息速览
本周无新药获批上市。
备注:(1)此处所列新药,主要是指国家药品监督管理局(NMPA)首次批准在中国上市的药品,包括新分子实体(以及包含有新分子实体的复方)、生物药、中药和疫苗。其中,新分子实体主要是化药注册分类下的1类(境内外均未上市的创新药)、5.1类(境外上市的原研药申请在国内上市);生物药主要为NMPA首次批准的国产及进口生物药;不包括生物类似物、新适应症、新剂型。(2)更多信息如获批临床品种相关靶点、研发企业、全球上市及研发进展及相关靶点全局分析等,可通过摩熵医药投融资数据库获取并下载EXCEL表格。
同期事件:
1. 2024年第38周09.16-09.22国内仿制药/生物类似物申报/审批数据分析
2. 2024年第38周09.16-09.22国内医药大健康行业政策法规汇总
3. 2024年第38周09.16-09.22全球医药大健康行业投融资数据
4. 2024年第38周09.16-09.22全球创新药研发概览
以上内容均来自{摩熵咨询医药行业观察周报(2024.09.16-2024.09.22)},如需查看或下载完整版报告,可点击!
<END>
想要解锁更多药物研发信息吗?查询摩熵医药数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!



















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论