本周药品审评进展要点
1、2021.07.09-202107.15期间药审中心受理总量为259个,涉及品种186个
2、28个1类新药申请临床获CDE受理
3、新增19个按仿制药质量和疗效一致性评价品种申报的受理号
4、6个品种通过(含视同通过)一致性评价
5、6款国产新药获批上市:国内首个英夫利西单抗生物类似药获批
数据统计时间段为2021年7月9日-2021年7月15日,药融云将定期公示一致性评价过评信息,关注公众号即可定期查看。如有疏漏,欢迎指正!
2021年7月9日至7月15日期间,共有6款国产新药、3款进口药获批上市;另有6个品种通过(含视同通过)一致性评价。有广东华润顺峰药业「佐匹克隆片」、北京诚济制药「福多司坦口服溶液」和海南华益泰康药业「琥珀酸美托洛尔缓释片」这3款首仿获批上市,泰州迈博太科药业国内首个英夫利西单抗生物类似药获批,具体信息如下:
6款国产新药获批上市
重点药物介绍:注射用英夫利西单抗
迈博药业的注射用英夫利西单抗生物类似药(CMAB008)获批上市。英夫利西单抗是一种抗肿瘤坏死因子(TNF-a)单克隆抗体,最初由强生公司开发,于1998年8月被FDA批准用于治疗克罗恩病,成为FDA批准的首款TNF-a抑制剂,随后该药又被批准用于治疗类风湿关节炎、强直性脊柱炎、银屑病等自身免疫性疾病。
该药本次在国内获批的适应症包括:类风湿关节炎、成人及儿童克罗恩病、瘘管性克罗恩病、强直性脊柱炎、银屑病及成人溃疡性结肠炎患者,商品名为类停。这是国内首家获批上市的英夫利西单抗生物类似药。
3个品种批准进口
过评品种信息:6个过评,含3款首家

一、在审评审批阶段
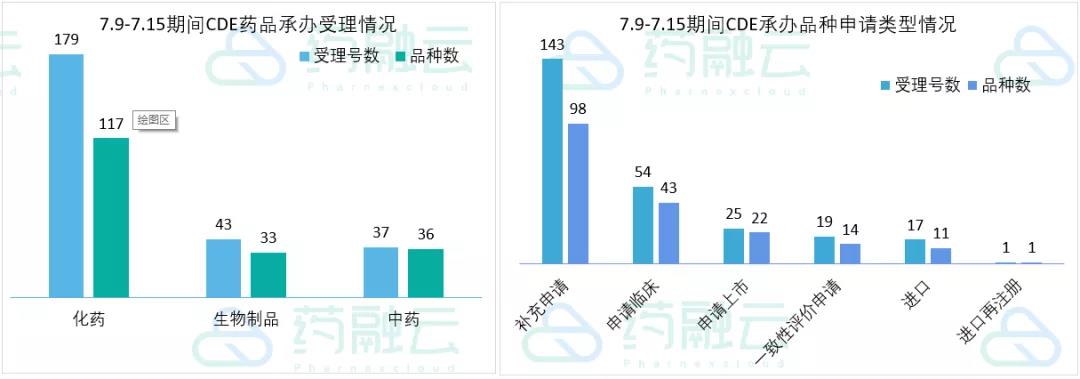
根据药融云中国药品审评数据,7月9号-7月15号期间共186个(按品种计,下同)药品获CDE承办,包括化药117个,生物制品33个,中药36个。
近期CDE承办的共有43个品种申报临床,其中包括35款国产新药,另有14个品种提交一致性评价。
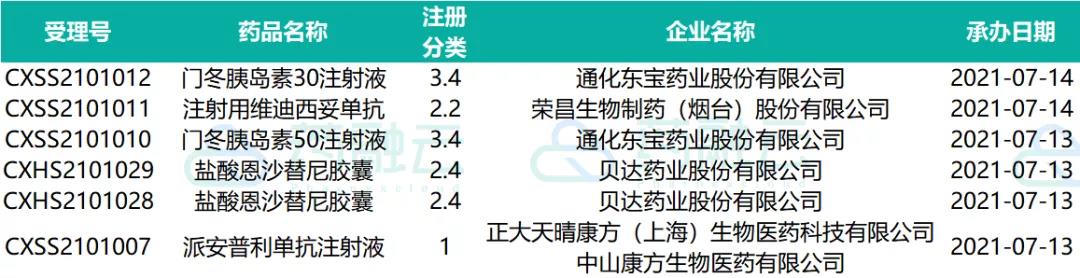
近期受理国产新药共计49个受理号,涉及40个品种34家企业,其中正大天晴康方生物医药的派安普利单抗等5款药品提交上市申请,其余均为申请临床,这其中包括29款1类新药。
07.09-07.15申请上市的药物情况
重点药物介绍:派安普利单抗
派安普利单抗(研发代号:AK105,商品名:安尼可)由康方生物与中国生物制药旗下公司正大天晴药业共同开发,适应证为联合化疗一线治疗局部晚期或转移性鳞状非小细胞肺癌(NSCLC)。
这是派安普利单抗继三线治疗转移性鼻咽癌通过RTOR新政成功在美国提交BLA,以及治疗至少经过二线系统化疗复发或难治性经典型霍奇金淋巴瘤成功在中国提交NDA后,成功提交的第三个上市申请。
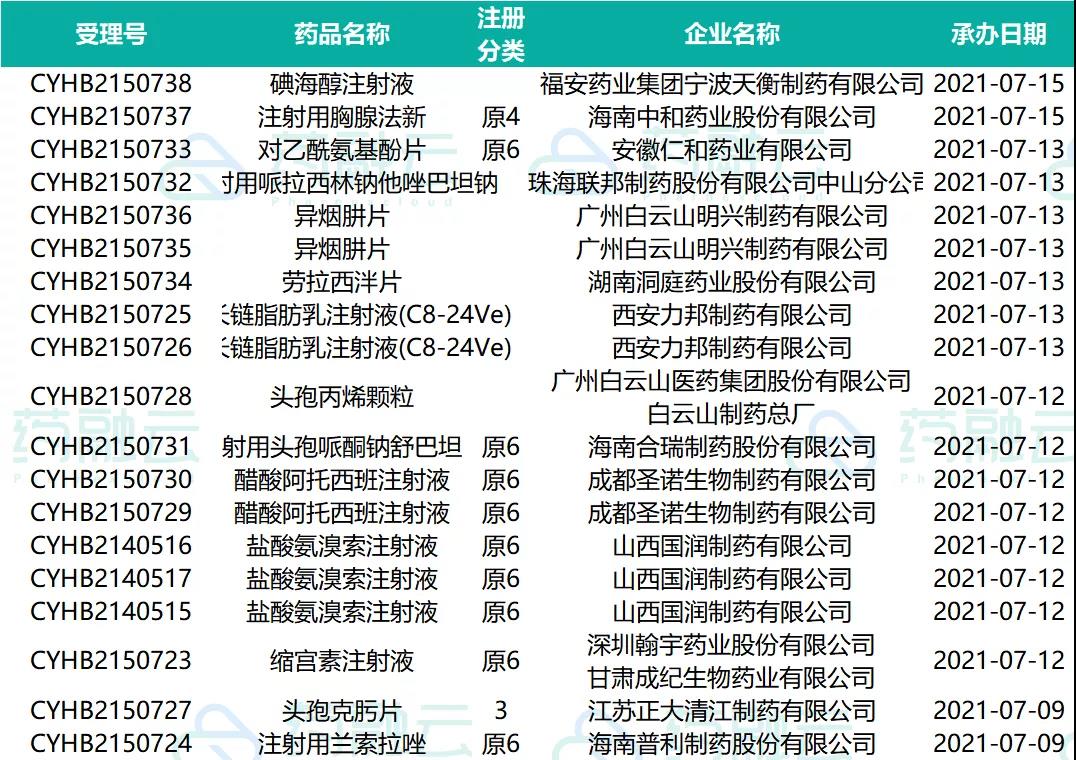
07.09-07.15申请临床的新药药物情况
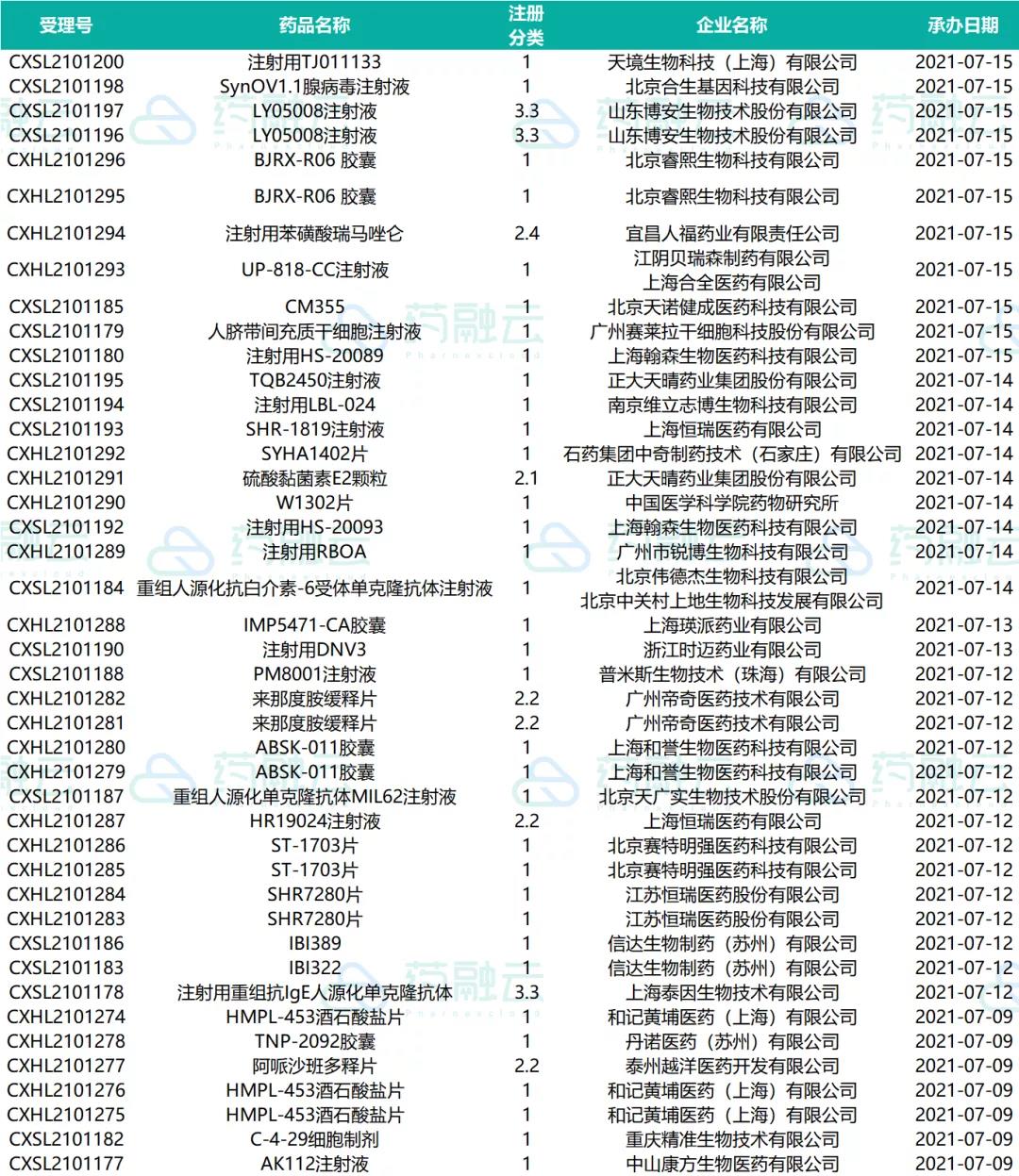
07.09-07.15申请临床的进口药物情况
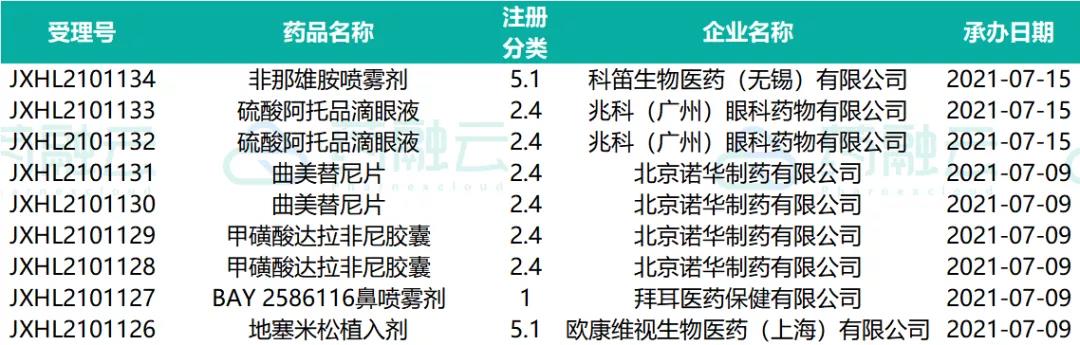
07.09-07.15申请进口的进口药药物情况
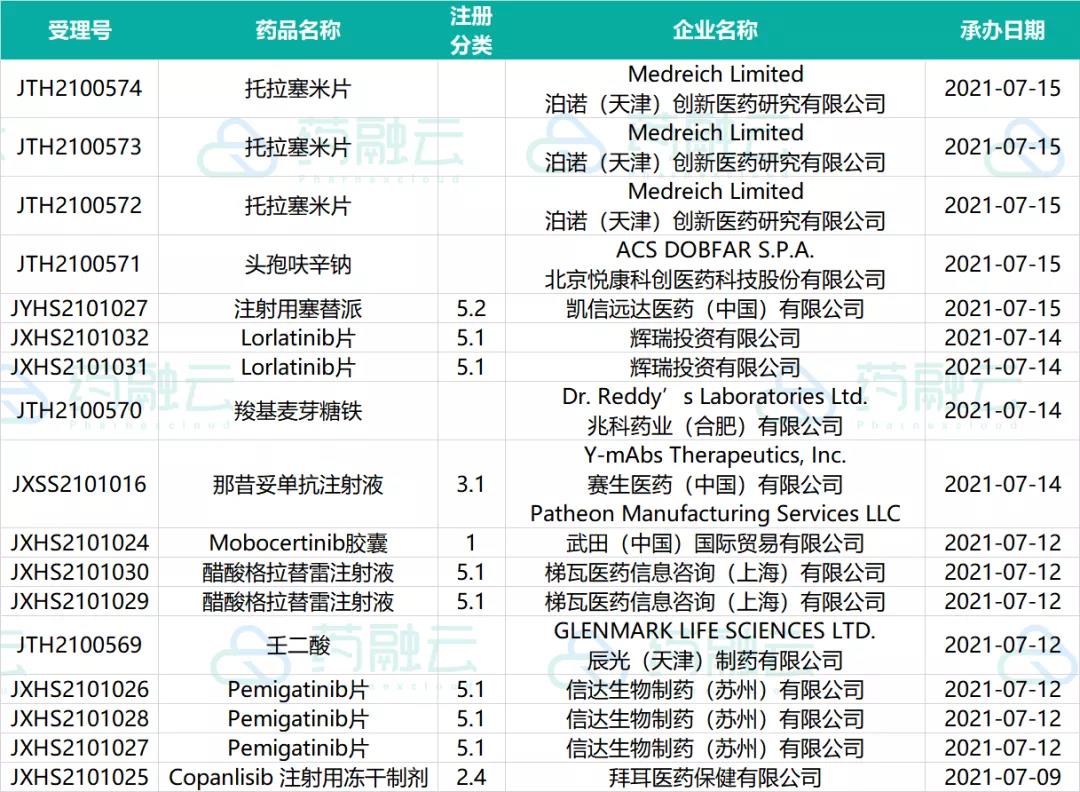
二、在审批阶段
近期共有14个品种(25个受理号)进入审批阶段。
07.09-07.15在审批阶段药物情况

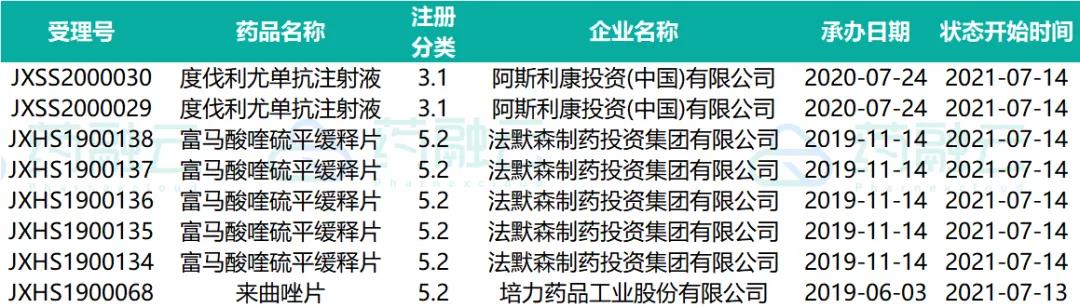
三、制证完毕-待发批件
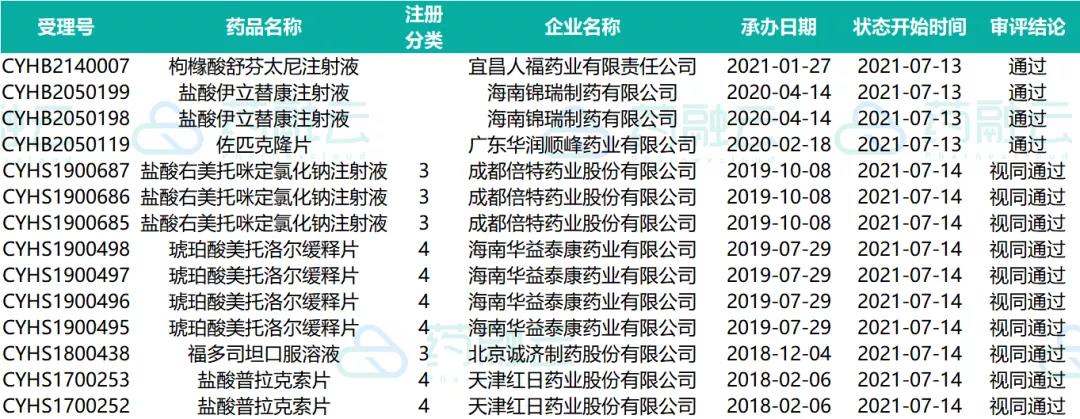
近期共计48个品种(涉及受理号83个)制证完毕-待发批件。其中有3个品种通过一致性评价,4个品种视同通过一致性评价。下表是处于制证完毕-待发批件的过评药物情况。
07.09-07.15制证完毕-待发批件过评药物情况
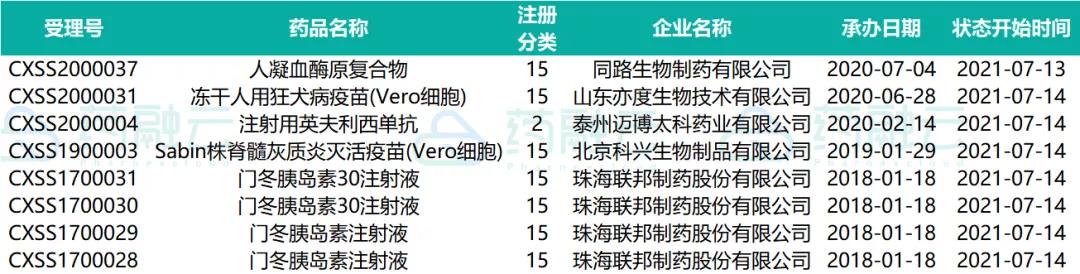
四、已发件药物情况
近期共计47个品种(涉及受理号57个)已发件,其中有7个品种通过一致性评价。下表是已发件过评药物情况。
07.09-07.15已发件过评药物情况

五、一致性评价申请
近期有14个品种提交一致性评价申请。








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论