
12月23日,据NMPA官网最新公示,罗氏公司的创新药物莫妥珠单抗(Mosunetuzumab)已正式获得上市批准。这款药物主要用于治疗那些已经接受过至少两种系统性治疗的复发或难治性滤泡性淋巴瘤(FL)成人患者,为这些患者提供了新的治疗选择。
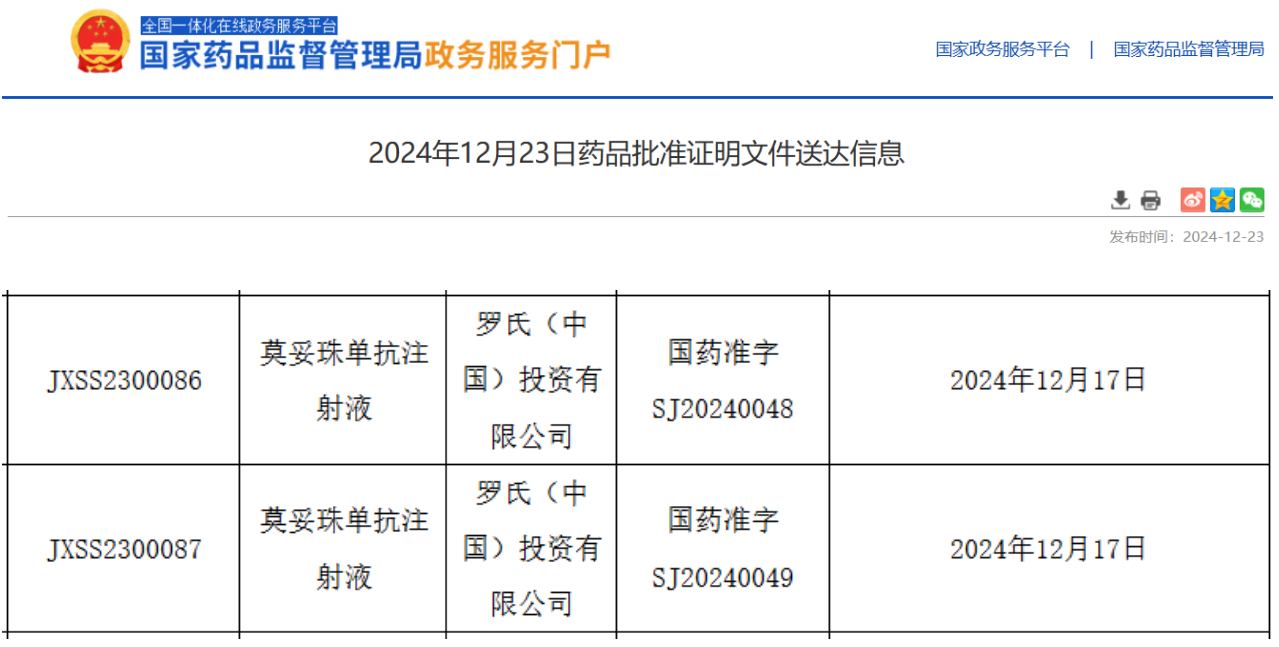
截图来源:NMPA
莫妥珠单抗是一款具有突破性的CD20/CD3 T细胞衔接双特异性抗体。它独特的设计使其能够同时靶向B细胞表面的CD20和T细胞表面的CD3,通过激活并重定向患者自身的T细胞,将细胞毒性蛋白精准地释放到B细胞中,从而有效消除恶性B细胞。
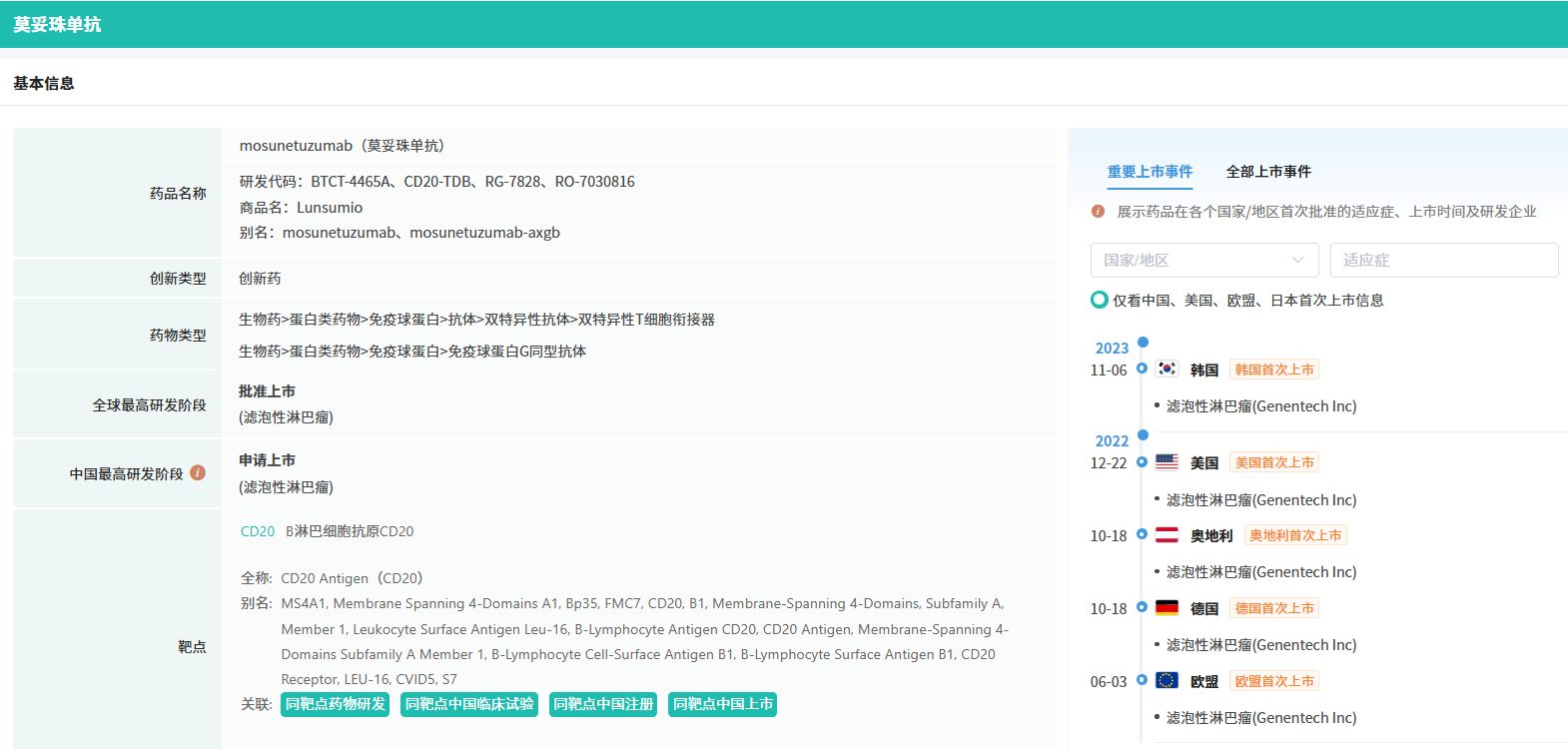
截图来源:摩熵医药数据库(全球药物研发数据库)
这款药物的研发成功,离不开其在临床试验中的优异表现。此前,基于一项代号为GO29781的多中心、开放标签I/II期研究的积极结果,莫妥珠单抗已经在欧盟和美国获得了上市批准,用于治疗与上述相同类型的淋巴瘤患者。在这项研究中,莫妥珠单抗展现出了令人瞩目的疗效,中位随访18.3个月后,患者的客观缓解率高达80%,完全缓解率更是达到了60%,中位缓解持续时间长达22.8个月。
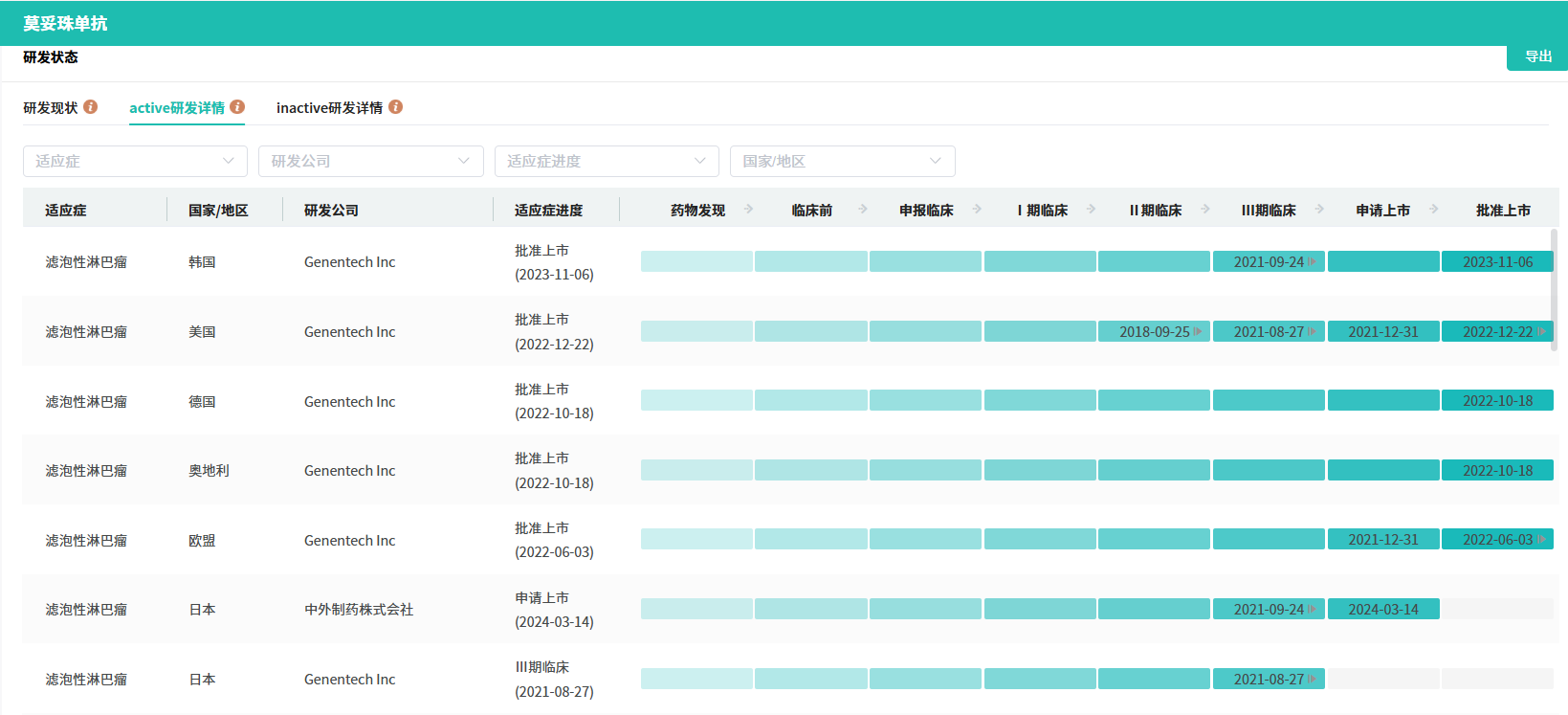
截图来源:摩熵医药全球药物研发数据库
尽管在治疗过程中,有部分患者出现了细胞因子释放综合征这一不良事件,但幸运的是,这些事件大多为低级别,并且在治疗结束后逐渐消退。这一数据无疑为莫妥珠单抗的安全性和有效性提供了有力的支持。
值得注意的是,莫妥珠单抗是罗氏在中国开发的第二款CD3/CD20双特异性抗体。在此之前,罗氏的另一款CD3/CD20双抗格菲妥单抗注射液(商品名:高罗华/Columvi)已经于2023年11月获得NMPA的附条件批准上市,用于治疗复发或难治性弥漫大B细胞淋巴瘤(DLBCL)成人患者。这也是国内首款获批的CD3/CD20双抗药物。
小结
12月23日,NMPA正式批准了罗氏的双抗药物莫妥珠单抗上市,为复发或难治性滤泡性淋巴瘤患者提供了新的治疗希望。这款药物通过独特的双重靶向机制,实现了对恶性B细胞的有效消除,并在临床试验中展现出了优异的疗效和安全性。同时,这也是罗氏在中国开发的第二款CD3/CD20双抗药物,标志着罗氏在淋巴瘤治疗领域的不断创新和突破。
想要解锁更多药物研发信息吗?查询摩熵医药(原药融云)数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论