
8月1日,全球领先的RNAi治疗公司Alnylam Pharmaceuticals (Nasdaq: ALNY),发布2024年第二季度业绩:2024年上半年总收入11.54亿美元,同比增长80.9%;净产品收入7.75亿美元,同比增长33.2%,这主要得益于AMVUTTRA因患者需求增加而实现的强劲增长,以及使用GIVLAARI和OXLUMO疗法患者人数的增加。其中2024 Q2总收入6.6亿美元,同比增长107%;净产品收入4.1亿美元,同比增长34.1%。

2024年合并净产品收入指导上调至15.75亿美元至16.5亿美元。

主要产品收入情况
Alnylam目前上市了五款药物,其中Leqvio由诺华获得了开发、生产和商业化的全球权利,据诺华财报2024 Q2销售额1.82亿美元,同比增长134%,2024 H1销售额为3.33亿美元,已接近2023年全年销售额。
其他四款RNAi产品ONPATTRO、AMVUTTRA、GIVLAARI和OXLUMO 2024 H1全球总净产品收入为7.75亿美元(约56.12亿元);2024 Q2全球总净产品收入为4.1亿美元(约29.69亿元)。
ATTR-PN siRNA产品:ONPATTRO(patisiran)和AMVUTTRA(vutrisiran)
总TTR继续保持增长势头,第二季度ONPATTRO和AMVUTTRA的全球总产品净收入为3.07亿美元,与2024 Q1相比,总TTR季度增长率为16%,与2023 Q2相比,年增长率为37%,其中美国的年增长率为40%。

Onpattro在2024 H1销售额14.65亿美元,同比下降24.5%;2024 Q2销售额7724.4万美元,同比下降16%。Onpattro是首款获得FDA批准的RNAi疗法(2018年8月获批),用于治疗由遗传性转甲状腺素蛋白淀粉样变性引起的周围神经疾病(多发性神经病)成人患者。
Amvuttra2024 H1销售额4.25亿美元,同比增长81.8%;2024 Q2销售额2.3亿美元,同比增长74%。该药物在2022年6月获得FDA批准,用于治疗成人遗传性转甲状腺素蛋白淀粉样变性伴多发性神经病(hATTR-PN),这是全球第5款获批上市的siRNA疗法,也是FDA批准的首款只需每3个月皮下注射一次,就能够逆转神经病损伤的RNAi疗法,同年9月获得欧盟批准。
两款罕见病产品:GIVLAARI® (givosiran) & OXLUMO® (lumasiran)
GIVLAARI 和OXLUMO在第二季度实现全球总净产品收入1.03亿美元。与2024 Q1相比,季度总增长率为2%;与 2023Q2相比,年增长率为25%。

GIVLAARI 2024 H1销售额1.2亿美元,同比增长13.6%;2024 Q2销售额6212.7万美元,同比增长7%。GIVLAARI(givosiran)是以ALAS1为靶点的 RNAi 疗法,已在美国和巴西获批用于治疗成人急性肝性卟啉症 (AHP)。欧盟也批准 GIVLAARI 用于治疗成人和 12 岁及以上青少年的急性肝性卟啉症。
OXLUMO 2024 H1销售额8325.7万美元,同比增长72.11%;2024 Q2销售额4060.8万美元,同比增长68%。受强劲需求推动,美国地区销售额大增79%。OXLUMO是针对HAO1的RNAi疗法,该药物主要用于治疗1型原发性高草酸尿症(PH1)。
研发亮点
- 6月24日,Alnylam公布了RNAi治疗药物vutrisiran的HELIOS-B 3期研究达到了主要终点和所有次要终点,包括基线tafamidis使用情况、ATTR疾病类型和疾病严重程度。根据此积极结果,Alnylam将使用优先审评券向美国FDA递交补充新药申请。(大涨35%!Alnylam 心脏病RNAi疗法3期研究成功)
- 4月,Anlynam宣布了其针对肝脏表达的血管紧张素原(AGT)的研究型RNAi疗法Zilebesiran的KARDIA-2 2期研究达到了主要终点和次要终点。结果表明,Zilebesiran组患者的平均收缩压实现了具有临床意义和统计学意义的降低,并且其具有令人鼓舞的安全性和耐受性。(一年两针!罗氏/Anlynam高血压RNAi疗法最新进展公布)
- 启动了针对脑淀粉样血管病(CAA)患者的cAPPricorn-1 2期研究,研究对象为 mivelsiran (ALN-APP)。
- 启动了ALN-KHK 1期研究的B部分,该研究正在开发中,用于治疗2型糖尿病。
- 合作伙伴赛诺菲向中国、巴西和美国提交了血友病研究药物fitusiran的监管申请,FDA 的目标行动日期为2025年3月28日。
其他业务更新
更新与 Regeneron 的合作协议。
根据修订后的许可协议,Regeneron获得cemdisiran作为单一疗法的独家权利,以换取1000万美元的预付款、某些监管里程碑以及cemdisiran作为单一疗法销售额的低两位数版税。Cemdisiran是一种皮下给药的研究性RNA干扰疗法,靶向C5补体,主要用于治疗补体蛋白引起的相关疾病。
由于Regeneron选择退出mivelsiran在CAA和阿尔茨海默病领域的进一步合作开发和合作商业化,因此Alnylam现在拥有mivelsiran在所有适应症领域的全部全球开发和商业化权利。如果mivelsiran获得批准,Regeneron将有资格从其销售额中获得较低的两位数版税。

公司管线
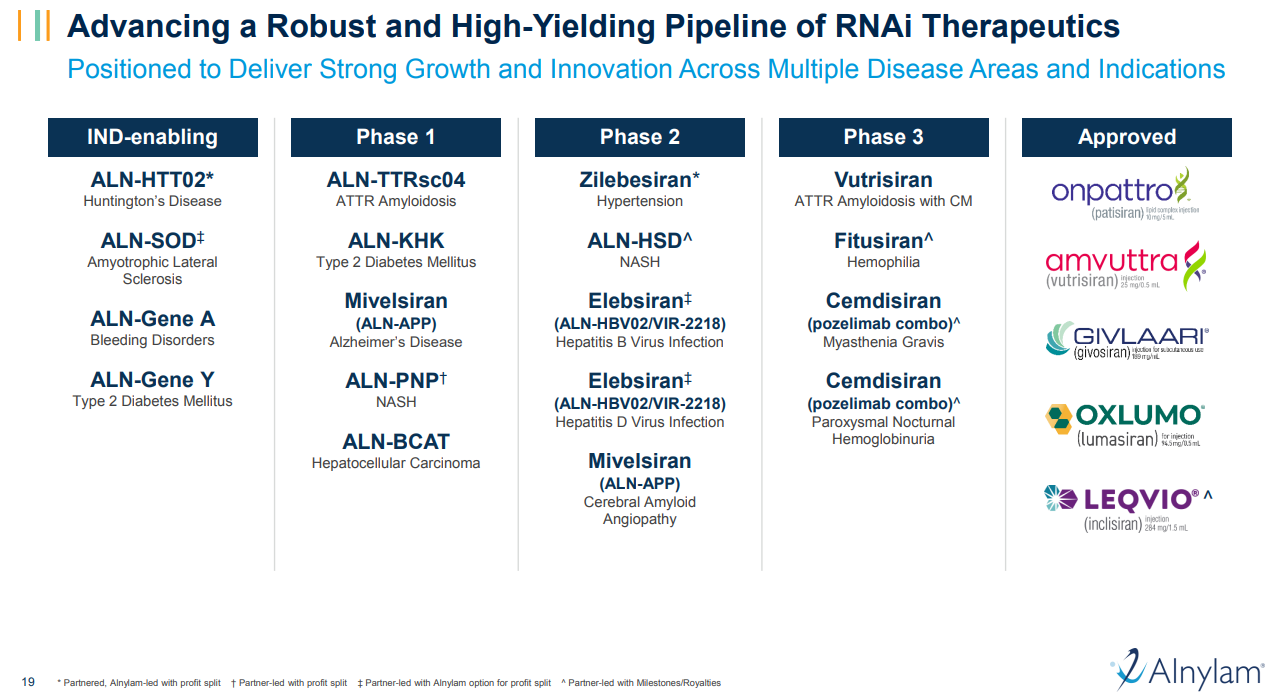
关于Alnylam
Alnylam Pharmaceutical率先将RNA干扰(RNAi)技术转化为一类全新的创新药物,有望改变那些患有罕见病和流行病且需求尚未得到满足的患者的生活。自2002 年成立以来,Alnylam一直引领着RNAi革命,并将继续实现将科学可能性转化为现实的大胆愿景。Alnylam的商业RNAi治疗产品包括 ONPATTRO® (patisiran)、AMVUTTRA® (vutrisiran)、GIVLAARI® (givosiran)、OXLUMO® (lumasiran) 和Leqvio® (inclisiran),后者正由Alnylam的合作伙伴诺华开发和商业化。Alnylam 拥有丰富的在研药物产品线,包括多个处于后期开发阶段的候选产品。Alnylam 正在实施其 "Alnylam P5x25 "战略,通过可持续创新和出色的财务业绩,在罕见病和常见病领域提供变革性药物,造福全球患者,从而成为一家领先的生物技术公司。
参考资料:公司财报
相关扩展阅读:2023年,RNAi重磅产品大卖65亿元
<END>
想要解锁更多药品信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论