
7月26日,欧洲药品管理局(EMA)的药品委员会(CHMP)表示,对卫材和百健的阿尔茨海默症药物Leqembi(Lecanemab)的批准给出负面意见。
根据EMA药品委员会(CHMP)的说法,这一决定是由于Leqembi在临床痴呆评分量表上仅比安慰剂有轻微的优势,以及潜在的严重副作用。淀粉样蛋白相关成像异常(ARIA)是Leqembi的一个副作用,可导致脑肿胀和潜在出血,这是主要问题。

CHMP表示,虽然在主要研究中,大多数ARIA病例并不严重,也没有症状,但有些患者出现了严重的症状,包括脑部大出血,需要住院治疗。此外,该机构还担心携带APOE4蛋白基因的人患ARIA的风险更高。
CHMP认为Leqembi在延缓认知能力下降方面的观察效果并不能抵消与该药相关的严重不良事件的风险。
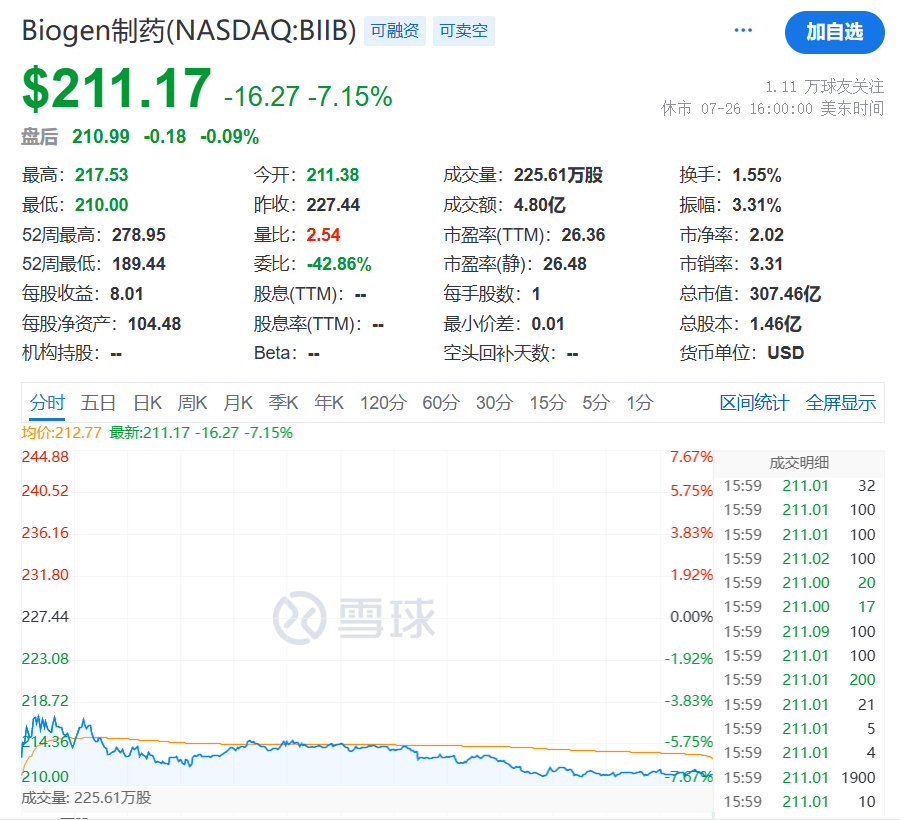
受此消息的影响,百健的股价下跌超过7%。
卫材和百健在一份声明中表示,他们将寻求重新审查CHMP的意见,并与相关当局合作,确保Leqembi在欧盟可用。2023年3月,卫材高管预计,到2030年,Leqembi在全球的销售额将达到70亿美元。
此前,CHMP还拒批了百健公司的另一种治疗阿尔茨海默病的药物Aduhelm,目前仍在审查礼来公司的donanemab。三种阿尔茨海默症药物Leqembi、Aduhelm和Donanemab目前均已在美国获得批准。
参考资料:www.endpts.com
<END>
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、临床试验情况、申报审批情况、各国上市情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论