
2023年,美国食品药品监督管理局(FDA)的新药批准数量创下了近五年的历史新高。据药融云美国FDA批准药品数据库统计,该年度FDA(CDER)共批准了55款新药,比前一年增加了近50%,达到自新冠疫情以来的最高点。
同时,FDA生物制品评估和研究中心(CBER)在2023年批准了14款生物制品,其中包括5款疫苗、5款基因治疗产品和2款细胞治疗产品。
2023年CDER新药批准数量接近顶峰,创新含量稳步攀升
2023年FDA新药批准数量的增加不仅仅是数量上的变化,更体现出创新含量的稳步攀升。在获批的55款新药中,具有创新机制的疗法占比超过六成,有15款新药曾获得过突破性疗法认定。这些创新药物在癌症与罕见病治疗领域占据主导地位,占比分别为44%与25%。
从药物类型上看,2023年的新药批准包括38款新分子实体(NME)和17款生物制品。在新分子实体中,小分子药物仍然是创新的主力军,占据了约55%的份额。此外,抗体类药物在生物制品中占据主导地位,占比达到71%。
2023年美国FDA新药申报企业TOP10
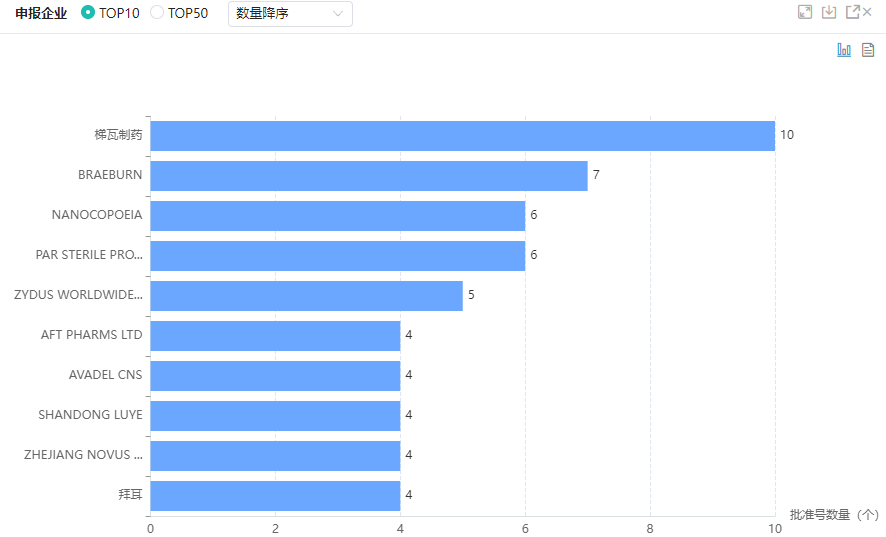
图片来源:药融云美国FDA批准药品数据库
获批新药适应症百花齐放,罕见病药物研发热情高涨
从治疗领域来看,获批新药所治疗的疾病也展现出多样化的趋势,多集中在肿瘤领域(25%)和罕见病(24%),其次为免疫炎症、感染、神经系统、心血管及代谢类疾病。
值得一提的是,在FDA的政策鼓励下,药企对罕见病治疗药物的研发热情依然高涨,是近年来新药产出最主要的领域之一。2023年罕见疾病收获颇丰,罕见病药物批准数量多,治疗病种分布广泛,包括遗传性血管性水肿、全身性重症肌无力等,给诸多遗传性免疫缺陷性疾病患者带来新的治疗选择。
比如CHIESI FARMACEUTICI SPA的两款罕见病新药ELFABRIO(pegunigalsidase alfa-iwxj)和LAMZEDE(velmanase alfa-tycv),武田(Takeda)的Adzynma(apadamtase alfa),均为酶替代疗法。
ELFABRIO是α-半乳糖苷酶的工程版本,是一种水解溶酶体中性鞘糖脂特异性酶,被转运到溶酶体后,发挥酶活性减少累积的Gb3,用于治疗成人法布里病患者。
LAMZEDE是人α-甘露糖苷酶的重组形式,旨在为人体补充天然α-甘露糖苷酶,该酶参与降解富含甘露糖的寡糖,以防止其在体内各种组织内蓄积,用于治疗成人和儿童患者的α-甘露糖苷症(AM)的非中枢神经系统表现。
Adzynma(TAK-755)是一款ADAMTS13重组蛋白,可以替代缺失或功能失常的ADAMTS13酶,通过补充ADAMTS13酶功能,可以有效改善cTTP的急、慢性症状,以及其他由ADAMTS13缺陷引起的合并症,从而改善CTTP患者的生活质量和寿命,用于先天性血栓性血小板减少性紫癜(cTTP)成人和儿童患者的预防性或按需酶替代疗法(ERT)。
Adzynma基本信息查询
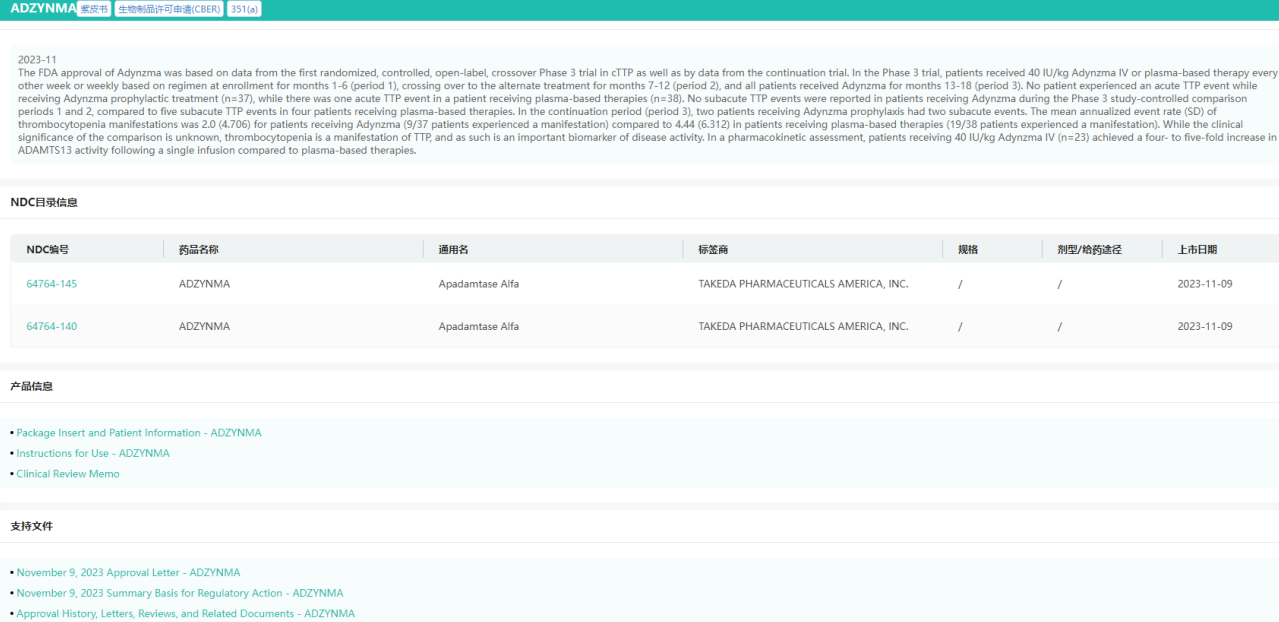
图片来源:药融云美国FDA批准药品数据库
与此同时,在众多重磅产品中,卫材和渤健的阿尔茨海默氏症治疗药物Leqembi(lecanemab)的获批备受关注。这款药物的批准为阿尔茨海默氏症患者提供了新的治疗选择,有助于延缓疾病的进展。此外,礼来公司的肥胖治疗药物Zepbound(tirzepatide)也备受瞩目,该药物的批准为肥胖症患者提供了新的有效治疗方法。
诺华的PNH口服补体单药疗法Fabhalta(iptacopan)也为患者带来了新的希望。这是首款针对PNH疾病的口服补体抑制剂,将为患者提供方便、安全有效的治疗方案。GSK的全球首款被批准用于老年人的RSV疫苗Arexvy也在2023年获批上市,这款疫苗的批准为预防老年人呼吸道合胞病毒感染提供了有效手段。
此外,首个治疗产后抑郁症(PPD)的口服药物Zuranolone也获得了批准。这款药物的上市将为产后抑郁症患者提供新的治疗选择,有助于改善他们的生活质量。
辉瑞成最大赢家,3款新药来自中国药企
从申报企业来看,辉瑞公司无疑是2023年新药获批的最大赢家,共获得6款新药批准,其中包括溃疡性结肠炎新药VELSIPITY、斑秃新药LITFULO、偏头痛新药ZAVZPRET、新冠口服药物PAXLOVID、多发性骨髓瘤双抗ELREXFIO以及人生长激素类似物NGENLA。这些新药的获批进一步巩固了辉瑞在医药行业的领先地位,并为患者提供了更多治疗选择。
渤健也收获了4款新药的批准,包括与日本卫材合作的阿尔茨海默病药物LEQEMBI、与Ionis公司合作的反义寡核苷酸疗法QALSODY、与Sage Therapeutics合作的产后抑郁症口服药ZURZUVAE以及收购Reata Pharmaceuticals所得的罕见病新药SKYCLARYS。
此外,还有来自中国药企的3款新药获得FDA批准,包括君实生物的PD-1单抗Loqtorzi(特瑞普利单抗)、和黄医药的VEGFR抑制剂Fruzaqla(呋喹替尼)和亿帆医药的长效G-CSF产品Ryzneuta(艾贝格司亭α注射液)。
君实生物Loqtorzi基本信息查询

图片来源:药融云美国FDA批准药品数据库
国产创新药大丰收!获批国产新药数量创新高
2023年,我国药品审评审批制度改革迈入第八个年头。随着疫情影响的消退,药品审评审批节奏恢复正常,国产创新药迎来了前所未有的丰收。据药融云数据库统计,2023年国家药品监督管理局(NMPA)批准了82款新药(不包括新增适应症、新剂型、生物类似药),创下近年来新药获批数量的历史新高。
这一年,39款国产新药成功获批,涵盖了小分子、抗体类、细胞疗法、融合蛋白、血液制品以及疫苗、中药等多种药物类型。这些新药针对的疾病领域广泛,包括肿瘤、自身免疫、消化、心血管、感染等。
从治疗领域分布来看,2023年获批的国产1类新药主要集中在肿瘤领域、消化系统领域和内分泌系统领域。其中,抗肿瘤药的获批数量最多,占据了半壁江山。其次是消化系统与代谢药,第三为血液和造血系统用药。
在审评方式上,有7款国产1类新药通过优先审评审批方式获批上市,其中包括4款化学药品和3款治疗用生物制品。这些药物在临床试验阶段就表现出卓越的疗效和安全性,得到了国家药品监管部门的认可。
从获批企业来看,恒瑞医药凭借其自主研发和引进的实力,有3款新药获批。贝达药业和信达生物也各有2款国产新药获批。此外,多个生物技术公司也实现了首个上市的1类新药的突破,包括驯鹿生物、迪哲医药、合源生物等。这些企业的成功不仅体现了我国药品研发实力的不断提升,也为患者提供了更多治疗选择。
2023年获批的国产新药(部分展示)
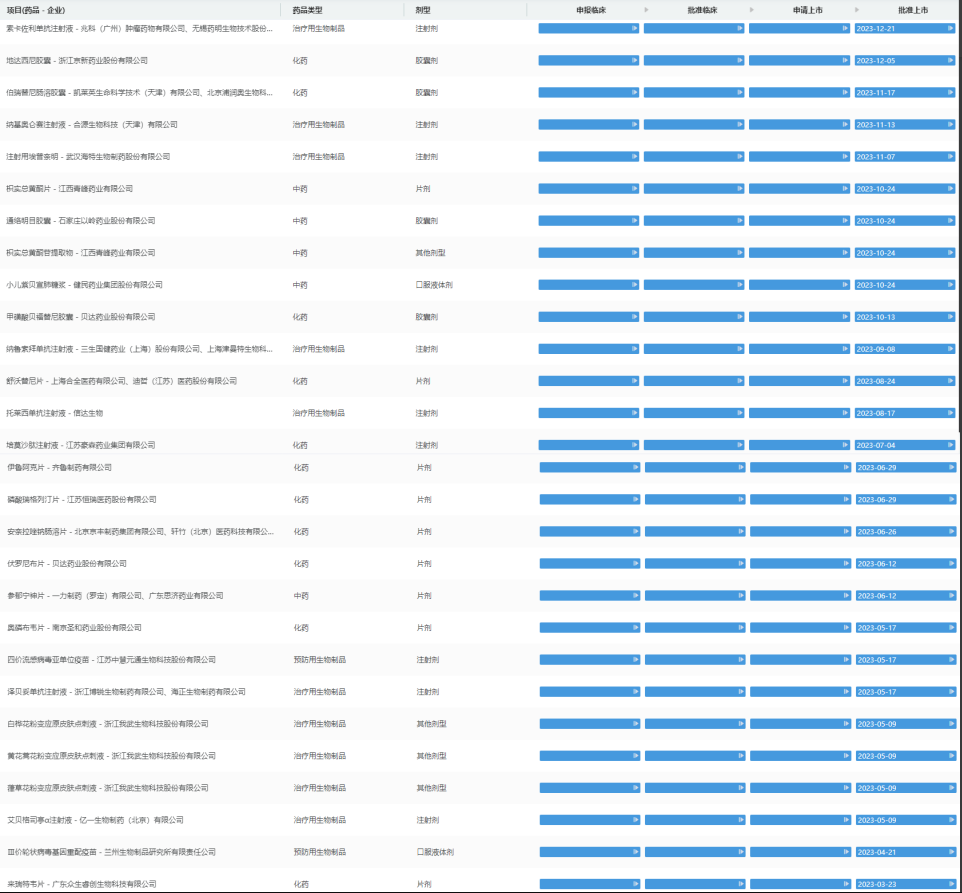
图片来源:药融云中国药品审评数据库
近70款新药获批新适应症,PD-1/L1单抗药物最多
除了首次获批的新药,药融云数据库显示,2023年还有近70款新药在中国获批新适应症(不含疫苗和诊断类产品),这些新适应症的研发涵盖了多个疾病领域,从常见病到罕见病,充分展现了我国药品研发的全面性和创新性。
获批新适应症的新药中,小分子药占比约63%,生物药占比约为37%。小分子药主要涉及小分子酪氨酸酶抑制剂、BTK抑制剂、JAK抑制剂、CDK4/6抑制剂和SGLT2抑制剂等类型。生物药则涵盖抗PD-1/L1单抗、CD38单抗、抗IgE单抗等。
其中,抗PD-1/L1单抗类药物的新适应症数量占据了主导地位。这一类药物通过调节免疫系统,增强患者自身的抗癌能力,为癌症治疗带来了革命性的突破。在2023年,多款抗PD-1/L1单抗药物成功扩大了适应症范围,覆盖了更多类型的癌症,为患者提供了更多治疗选择。
例如,康方生物/正大天晴、复宏汉霖、恒瑞医药、百时美施贵宝和阿斯利康等公司的10款抗PD-1/L1单抗获批新适应症,覆盖非小细胞肺癌、小细胞肺癌、尿路上皮癌、肝癌、胃癌、食管癌、淋巴瘤、胆道癌以及MSI-H或dMMR成人晚期实体瘤等领域。
除了抗PD-1/L1单抗类药物,JAK抑制剂也成为新适应症研发的亮点。这类药物通过抑制JAK激酶活性,治疗多种炎症性疾病和自身免疫性疾病。在2023年,多款JAK抑制剂成功获得新适应症批准,进一步扩大了其在临床治疗中的应用范围。比如艾伯维的乌帕替尼缓释片、礼来的巴瑞替尼片和诺华的磷酸芦可替尼片,在中国获批用于治疗溃疡性结肠炎、克罗恩病、强直性脊柱炎、重度斑秃的系统性治疗和急性移植物抗宿主病等新适应症。
乌帕替尼缓释片上市时间轴及研发现状查询
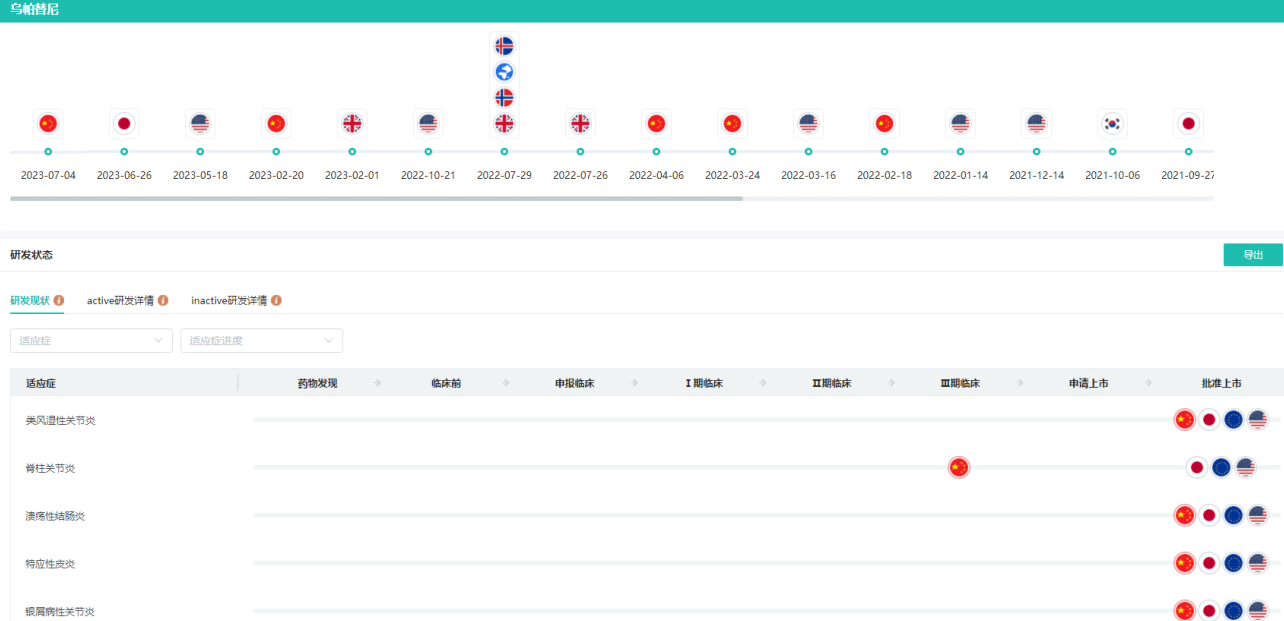
图片来源:药融云全球药物研发数据库
此外,还有多种创新疗法获得新适应症批准,如拜耳的雄激素受体抑制剂达罗他胺、诺诚健华的BTK抑制剂奥布替尼、诺华的CDK4/6抑制剂瑞波西利、基石药业的RET抑制剂普拉替尼、绿叶制药的GnRH激动剂戈舍瑞林微球以及亚盛医药的第三代BCR-ABL抑制剂奥雷巴替尼等。
总结而言,2023年国产新药适应症的研发与审评工作取得了辉煌的成就。这一成就的背后是无数科研人员的辛勤付出、药企的不懈努力以及国家政策的支持。展望未来,我们有理由相信,我国药品研发将继续走在创新与突破的道路上,为全球患者带来更多的希望与福祉。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!


















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论