
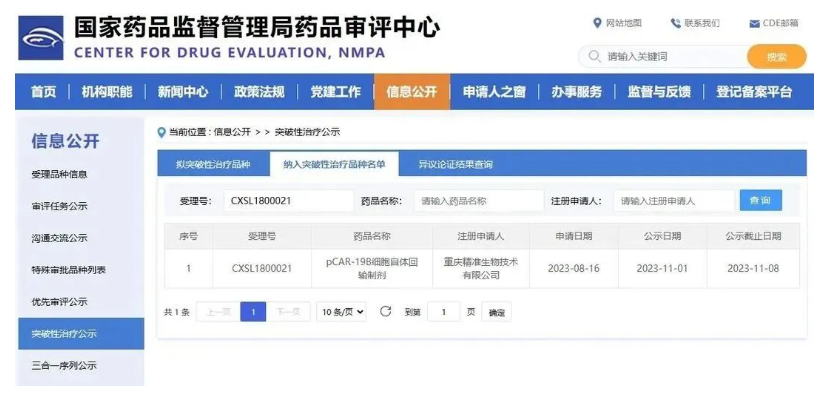
11月10日,中国国家药监局药品审评中心(CDE)官网信息公布,精准生物申报的pCAR-19B细胞自体回输制剂(以下简称pCAR-19B)获准纳入“突破性治疗品种”。适用于治疗3~21岁患有CD19阳性复发/难治性急性淋巴细胞白血病(B-ALL)的患者。该产品预计2024年上市。
pCAR-19B突破性
目前,国内尚无治疗儿童、青少年复发/难治性B细胞急性淋巴细胞白血病的CAR-T产品获批上市。pCAR-19B作为国内首款该适应症进入关键性临床研究的CAR-T产品,此次被纳入突破性治疗审评程序,基于其注册临床研究突出的临床疗效和患者获益,相较已有治疗手段,显著提高了客观缓解率。
当前,pCAR-19B关键临床研究已达到主要终点,我们期待pCAR-19B更有意义的相关结果公开,并在国家突破性治疗审评程序的加持下尽快面世,为儿童、青少年复发/难治性B细胞急性淋巴细胞白血病患者提供有效的新选择。
关于pCAR-19B
pCAR-19B由重庆精准生物自主研发,拥有发明专利保护,是针对CD19阳性B细胞起源的恶性血液系统疾病开发的细胞免疫治疗产品,也是国内首个针对该适应症的人源化设计的CAR-T产品。同时采用了更为安全的基因转导载体系统,从而具有更好的有效性和安全性。
pCAR-19B药物信息

截图来源:药融云全球药物研发数据库
2019年2月,pCAR-19B获得国家药品监督管理局一类生物新药临床试验默示许可。
2019年11月,I期临床研究在华中科技大学同济医学院附属同济医院正式启动,周剑峰教授担任PI(主要研究者)。该项注册试验也是我国首个针对儿童和青少年B细胞B细胞急性淋巴细胞白血病CAR-T注册临床试验。I期临床试验数据显示,入组的9例患者均获得完全缓解(CR),总体缓解率达100%,且首次达到完全缓解(CR)的患者微小残留病变(MRD)也均为阴性;无剂量限制性毒性(DLT)和治疗相关死亡事件发生,总体安全性和耐受性良好。
2022年2月,Ⅱ期注册临床试验在首都医科大学附属北京儿童医院和华中科技大学同济医学院附属同济医院正式启动,王天有教授和黄亮教授担任临床试验的主要研究者(leading PI),并相继在全国10余家三甲医院血液科开展临床试验,旨在能够更好的评估pCAR-19B的有效性和安全性。
目前精准生物已获得四个CAR-T细胞一类生物新药、七项适应症的默示许可,注册临床正在顺利推进并取得了优异的临床数据。pCAR-19B除了针对3~21岁患有CD19阳性复发/难治性B-ALL的患者,还在中国获批针对其他适应症开展临床研究,包括:22~70岁患有CD19阳性复发/难治性B细胞急性淋巴细胞白血病患者;75岁及以下复发/难治性CD19阳性弥漫大B细胞淋巴瘤、滤泡性淋巴瘤和套细胞淋巴瘤患者。
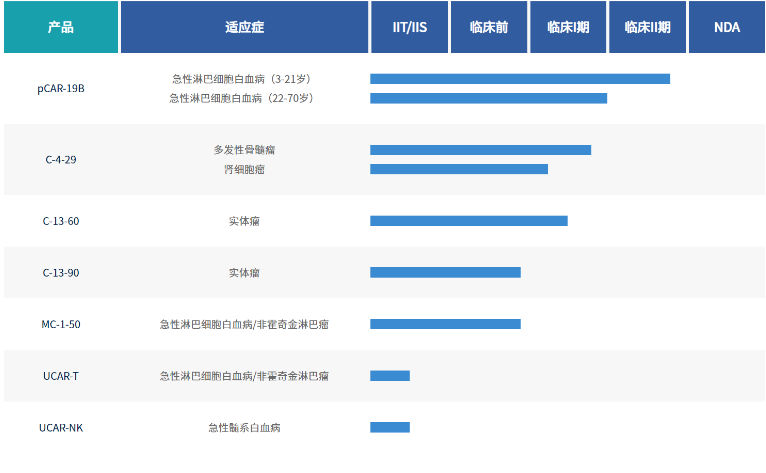
公司通过自主研发已拥有细胞治疗领域核心技术,并掌握免疫细胞治疗(多靶点CAR-T、通用型CAR-T、实体瘤CAR-T、高效制备CAR-T)、干细胞治疗、基因治疗等关键技术。布局白血病、淋巴瘤、骨髓瘤、肾癌、结直肠癌、肺癌、乳腺癌等十余条产品研发管线,已获得四个CAR-T细胞一类生物新药、七项适应症(含实体瘤)的注册临床默示许可。
研发管线
参考资料:
1.精准生物科技
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!










































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论