
9月25日,美国食品和药物管理局 (FDA) 的审查人员对成体干细胞疗法领军企业BrainStorm Cell Therapeutics(BCLI.US)治疗肌萎缩侧索硬化症 (ALS) 药物NurOwn 的安全性和有效性提出质疑。

NurOwn 将于 9 月 27 日接受美国FDA 细胞、组织和基因疗法咨询委员会的审查。届时,FDA 将提出强有力的理由,说明 BrainStorm 的临床试验证据为何未达到批准标准。
受此影响,BrainStorm股价大跌50%。目前市值为3672万美元。
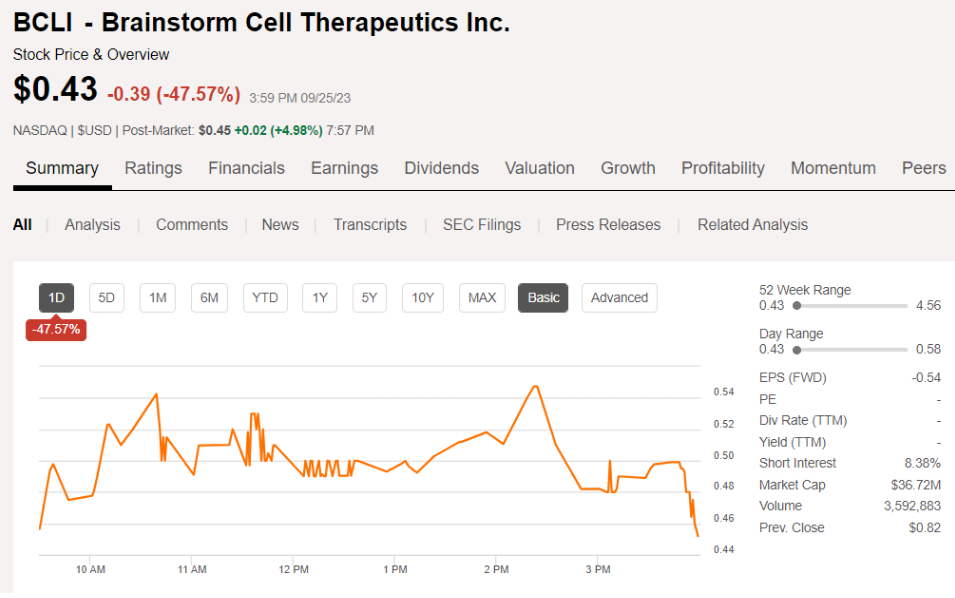
FDA审查员表示:NurOwn存在的质量和安全问题。因为该公司的 3 期研究显示,接受 NurOwn 治疗的 ALS 患者的生存率比接受安慰剂治疗的患者更差,表明接受该药物的患者缺乏生存获益。除了临床和统计问题外,FDA 审查员还指出了产品制造方面的问题以及缺乏相关数据问题。
鉴于此,FDA曾2次拒绝NurOwn的上市申请。
NurOwn是 Brainstorm 开发的一款在研间充质干细胞疗法,适应症是肌萎缩侧索硬化症 (ALS) 。据悉,这也是全球首个申请上市的渐冻症干细胞疗法。
ALS 是一种毁灭性的神经系统疾病,通常会在发病后3~5内死亡。而ALS药物的获批一直存在争议,例如2022年9月,FDA批准了由Amylyx研发的治疗ALS的药物Relyvrio,就引起争议。因为该药曾因疗效证据不足被否决,其获批过程引发诸多争议。2023年4月,FDA通过加速审批路径批准渤健的ALS疗法 Qalsody(tofersen)上市,并要求渤健对携带SOD1突变但尚未出现症状的ALS患者进行额外的试验。而在这之前Qalsody的3期临床研究未达到主要终点。
所以,BrainStorm 引用了这些先例为NurOwn的获批提供支持。
FDA及其顾问都认为,渤健 Qalsody减少血浆中神经丝轻链蛋白(NfL)的可能显示该药对SOD1-ALS患者有临床益处。但BrainStorm的药物NurOwn 在近 200 名 ALS 患者的 3 期试验中未达到主要终点和次要终点,而且接受NurOwn治疗的患者比安慰剂组死亡人数多。所以, BrainStorm药物与之前获批的ALS药物不能同日而语。
9月27日,由 20 名顾问组成的投票小组将对 BrainStorm 的临床试验数据是否符合 FDA获批标准进行投票,让我们一起关注最终结果。
关于BrainStorm Cell Therapeutics
BrainStorm Cell Therapeutics于2000年9月22日在美国注册成立,是一家成体干细胞疗法领军企业,专注于创新中枢神经系统(“CNS”)成人干细胞疗法的开发和商业化,该疗法旨在解决衰弱性神经退行性疾病患者的重大未满足的医疗需求。利用其专有的间充质干细胞平台技术,Brainstorm正在推进各种神经退行性疾病的治疗。
研发管线
截图来源:药融云全球药物研发数据库
参考资料:
1.https://www.biopharmadive.com/news/brainstorm-FDA-als-nurown-advisory-committee-documents/694577/
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!






























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)











 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论