
近日,Harpoon宣布,艾伯维公司将放弃对BCMA靶向多发性骨髓瘤药物HPN217的全球独家许可选择权。根据协议,该合作将于10月12日终止,之后HPN217将完全归Harpoon公司所有,Harpoon计划继续完成正在进行的1期临床试验。
2017年10月,Harpoon和艾伯维(AbbVie)达成免疫肿瘤学研究合作,主要利用Harpoon的TriTAC平台开发选定靶向药。2019年11月,Harpoon和艾伯维再次签订独家许可协议扩大相互之间的合作,促进Harpoon专有的TriTAC(三特异性T细胞活化构建体)平台的使用,以及Harpoon向艾伯维授予了其HPN217的全球使用权。此前艾伯维已支付了预付款5000万美元(HPN217预付3000万美元+扩大合作2000万美元)和首位患者入组治疗的里程碑付款5000万美元。
“对于既往治疗后病情进展的晚期多发性骨髓瘤患者,包括之前接受过BCMA靶向治疗的患者,其医疗需求存在重大未满足的医疗需求,我们仍然相信HPN217为这些患者提供差异化治疗选择的潜力。”Harpoon总裁兼首席执行官朱莉·伊斯特兰表示,“我们将在即将召开的IMS会议上与科学界分享中期结果。HPN217研究的初步数据继续令人鼓舞,安全性良好。”
艾伯维做出此项决定可能与其在BCMA定位领域的其他潜在更强大的投资有关。2021年6月艾伯维收购了TeneoOne及其复发或难治性多发性骨髓瘤资产TNB-383B。这种药物现在被命名为ABBV-383,正在进行一期临床试验。
关于HPN217
HPN217是基于Harpoon的新型TriTAC平台构建的靶向BCMA的三特异性T细胞激活构建物(TriTAC),用于治疗复发/难治性多发性骨髓瘤,其包含了3个人源化抗体衍生的结构域,结合多发性骨髓瘤细胞的BCMA、与T细胞结合的CD3和延长半衰期的白蛋白。HPN217具有较长的循环半衰期,可以重新引导T细胞杀死BCMA阳性肿瘤细胞。
HPN217基本信息
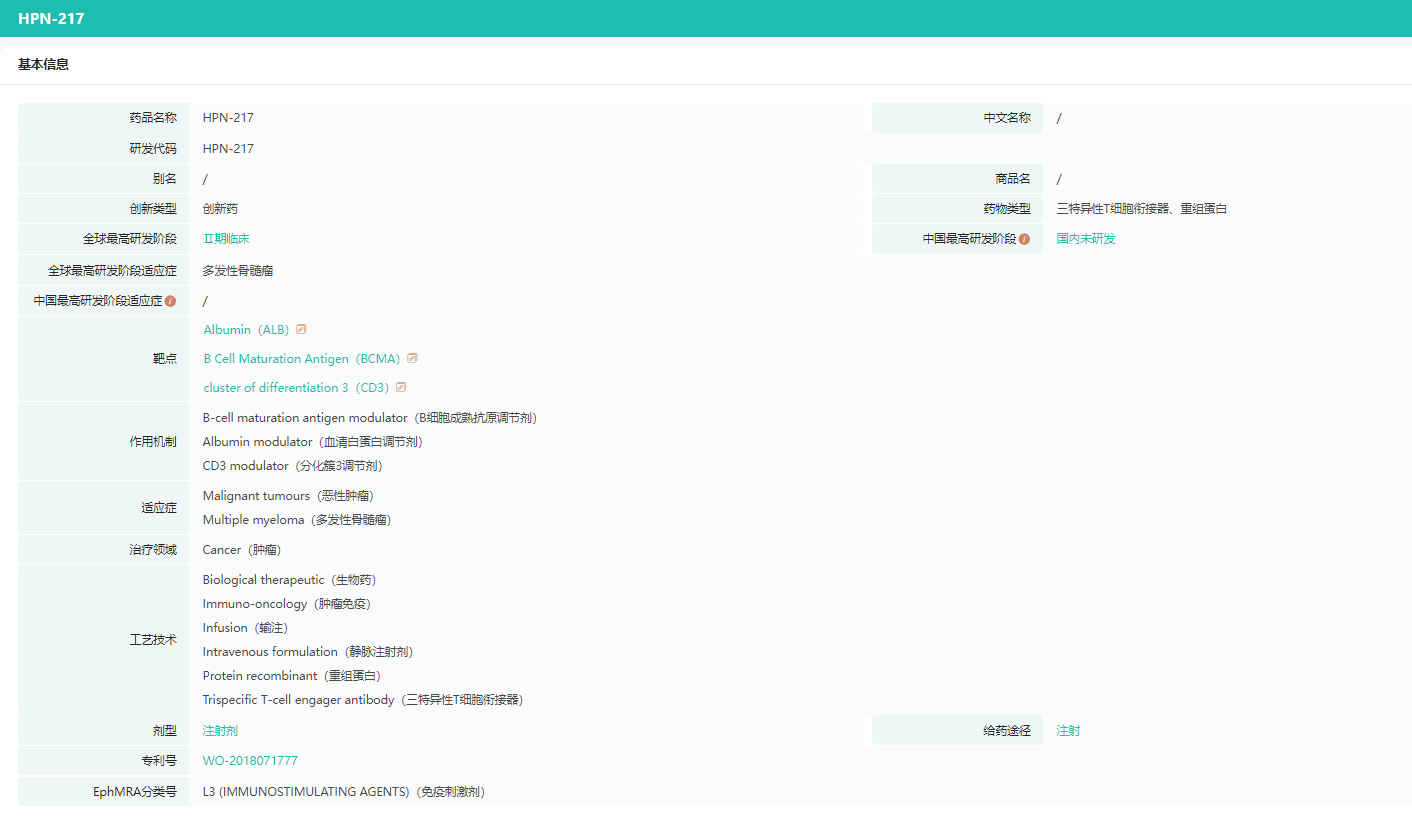
数据来源:药融云全球药物研发数据库
临床前数据表明,HPN217在细胞培养和异种移植动物模型中表现出基于BCMA和T细胞的抗肿瘤活性。药代动力学研究表明,HPN217在动物体内的半衰期为70-84个小时。重要的是,在血液循环中存在一周后,HPN217的功能仍然保持完整。此前HPN217已获得FDA快速通道指定和孤儿药资格。
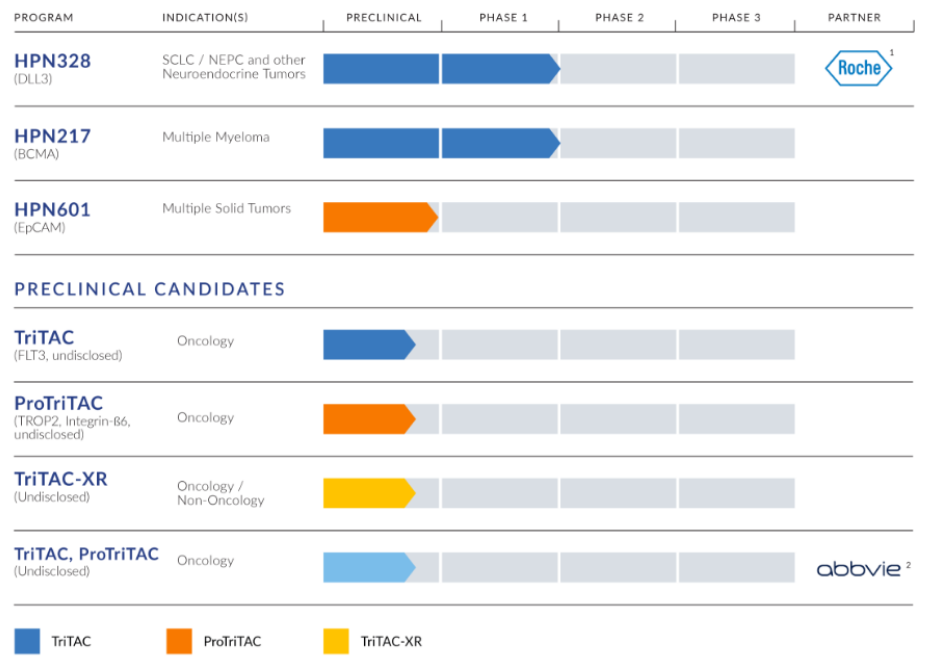
Harpoon将完成正在进行的复发性或难治性多发性骨髓瘤资产的第一阶段试验,临时数据将在9月28日的国际骨髓瘤协会(International Myeloma Society)年会上提交,目的是支持进一步开发。
关于Harpoon
Harpoon Therapeutics 是一家临床阶段的免疫肿瘤公司,开发一类新型T细胞接合剂,利用人体免疫系统的力量来治疗患有癌症和其他疾病的患者。T细胞接合剂是工程蛋白,可引导患者自身的T细胞杀死表达靶细胞携带的特定蛋白或抗原的靶细胞。
使用其专有的三特异性T细胞激活结构(TriTAC ®)平台上,Harpoon正在开发一系列新型TriTAC,最初专注于实体瘤和血液恶性肿瘤的治疗。Harpoon还开发了专有的ProTriTAC™平台,该平台将前药概念应用于其TriTAC平台,以创建一种治疗性T细胞接合剂,该接合剂在到达肿瘤之前保持非活性。Harpoon的第三个专有技术平台是缓释TriTAC-XR,旨在减轻细胞因子释放综合征。
参考资料:
1.公司官网
2.药融云数据库
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!












































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论