
掌握药物基本信息,聚焦市场竞争格局。《药融云医药行业观察周报》整理了2023.08.07-2023.08.13 期间,全球创新药研发进展,多款新药研发进展动态更新,涉及眼科疾病、帕金森病、肺癌、多发性骨髓瘤等领域。
1. 首款!安斯泰来新机制眼科药物获 FDA 批准上市
近日,安斯泰来(Astellas Pharma)宣布,美国 FDA 批准 avacincaptad pegol 玻璃体内注射液(商品名: Izervay)用于治疗年龄相关性黄斑变性(AMD)引起的地图样萎缩(GA)。
地图样萎缩是一种晚期的年龄相关性黄斑变性,是导致患者失明的主要原因,影响全世界超过 500 万人。该疾病平均历时 2.5 年,渐进式地蚕食负责中央视力的黄斑中央凹(fovea)部位,严重地损害患者的视觉功能、独立性以及生活品质。此疾病是由于过量补体活化引起不可逆病变,导致视网膜细胞受损所导致。
Izervay 是 Iveric Bio 旗下的一款补体 C5 蛋白抑制剂。借由靶向 C5 蛋白,Izervay 具潜力抑制补体系统活化,进而避免视网膜细胞萎缩与地图样萎缩病程的进展。2023 年 7 月 11 日,安斯泰来完成了对 Iveric Bio 的收购。
Izervay研发进度
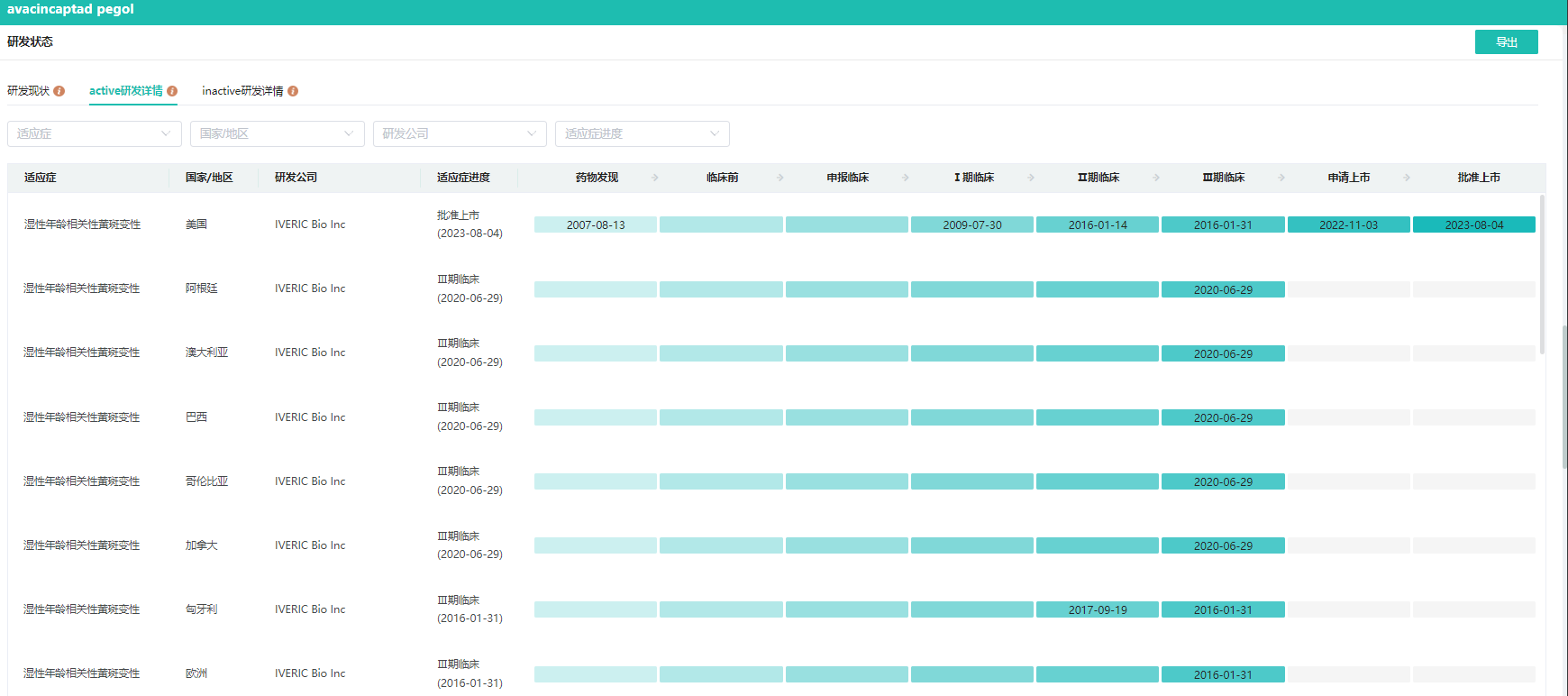
数据来源:药融云全球药物研发数据库
此次获批是基于 GATHER1 与 GATHER2 两项为期 12 个月的关键临床 3 期试验的结果,这两项临床试验评估了每月玻璃体内给药 2 mg Izervay 在继发于 AMD 的 GA 患者中的安全性和有效性。主要分析结果显示,与假性试验相比,接受 Izervay 治疗的患者的 GA 增长率在统计学上有显著降低,最早在 6 个月时就观察到了疾病进展的减慢,在治疗的第一年中 GA 增长率的下降高达 35%。
2. 辉大基因眼科基因疗法获 FDA 罕见儿科疾病认定
8 月 7 日,辉大基因宣布,其自主研发的新型眼科基因治疗药物 HG004 获得了美国 FDA 授予的罕见儿科疾病认定(RPDD),用于治疗由 RPE65 突变引起的遗传性视网膜疾病。
HG004特殊审批
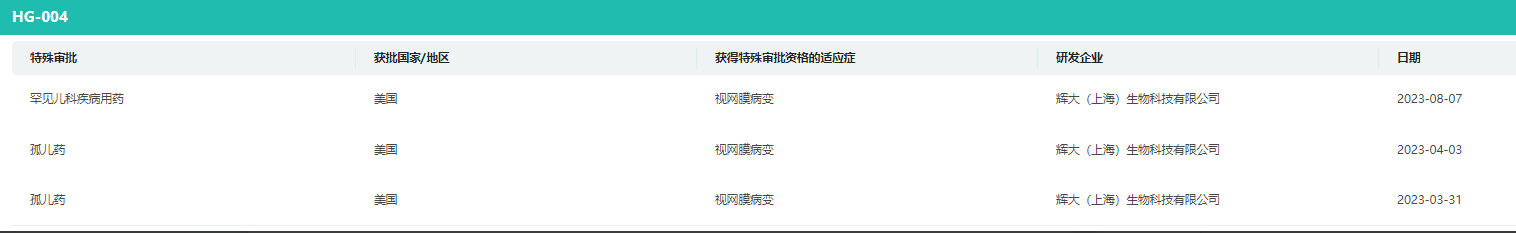
数据来源:药融云全球药物研发数据库
遗传性视网膜营养不良(IRDs)是一类由基因突变引起罕见致盲性疾病,已报道致病基因超过 250 个。其中,RPE65 基因突变可能会导致 Leber 先天性黑蒙、严重的早发性儿童视网膜营养不良、早发性严重视网膜营养不良或视网膜色素变性,即这些疾病都被认为是 RPE65 基因突变相关视网膜病变,代表同一疾病的表型连续体。RPE65 基因突变相关视网膜病变通常发病于出生至 5 岁之间,主要临床表征包括夜盲(凝视伴严重夜盲症和眼球震颤)、进行性视野缺失和中心视力丧失。HG004 注射液是一种新型眼科基因治疗药物,旨在用于治疗 RPE65 基因突变相关性视网膜病变。
据药融云数据库显示,HG004 已先后在美国和中国获批临床,将开展中国国际多区域、多中心同一主方案的基因治疗药物临床试验。该药还获得了 FDA 孤儿药资格,用于治疗由 RPE65 突变引起的遗传性视网膜疾病。
3. wangjinwww 亚盛医药 Bcl-2 抑制剂在美国获批关键 3 期临床
8 月 7 日,亚盛医药宣布,美国 FDA 已同意其核心产品 Bcl-2 选择性抑制剂 lisaftoclax(APG-2575)开展一项全球关键注册性 3 期临床研究,用于治疗既往接受治疗的慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。
APG-2575基本信息

数据来源:药融云全球药物研发数据库
CLL/SLL 是成人白血病的常见类型,全球每年新增病例超过 10 万例。尽管当前的一线治疗,如免疫疗法、化疗和 BTK 抑制剂对初治患者有显著反应,但复发和耐药是主要的临床挑战。CLL/SLL 的治疗中仍存在着显著的、未满足的临床需求,迫切需要新的治疗选择。Bcl-2抑制剂的面世,让CLL/SLL的治疗又有了进一步的革新,为BTK抑制剂治疗失败的患者提供了新的选择。
APG-2575 是亚盛医药自主研发的新型口服 Bcl-2 选择性抑制剂,通过选择性抑制 Bcl-2 蛋白,恢复癌细胞的正常凋亡过程,从而达到治疗肿瘤的目的。本次APG-2575在美国获批的是一项全球多中心、随机对照的注册 3期临床试验(APG2575CG301),旨在评估 APG-2575 联合布鲁顿酪氨酸激酶抑制剂(BTKi)用于治疗既往接受治疗的慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者中的疗效和安全性。该研究将于 2023 年下半年启动。
4. 礼来口服 GLP-1R 激动剂在中国启动 3 期临床
8 月 11 日,中国药物临床试验登记与信息公示平台官网显示,礼来公司(Eli Lilly and Company)已经启动一项国际多中心(含中国)3 期临床研究(ATTAIN-1 研究),在肥胖或超重伴体重相关合并症的受试者中评价 LY3502970 与安慰剂相比的有效性和安全性。
LY3502970研发进度
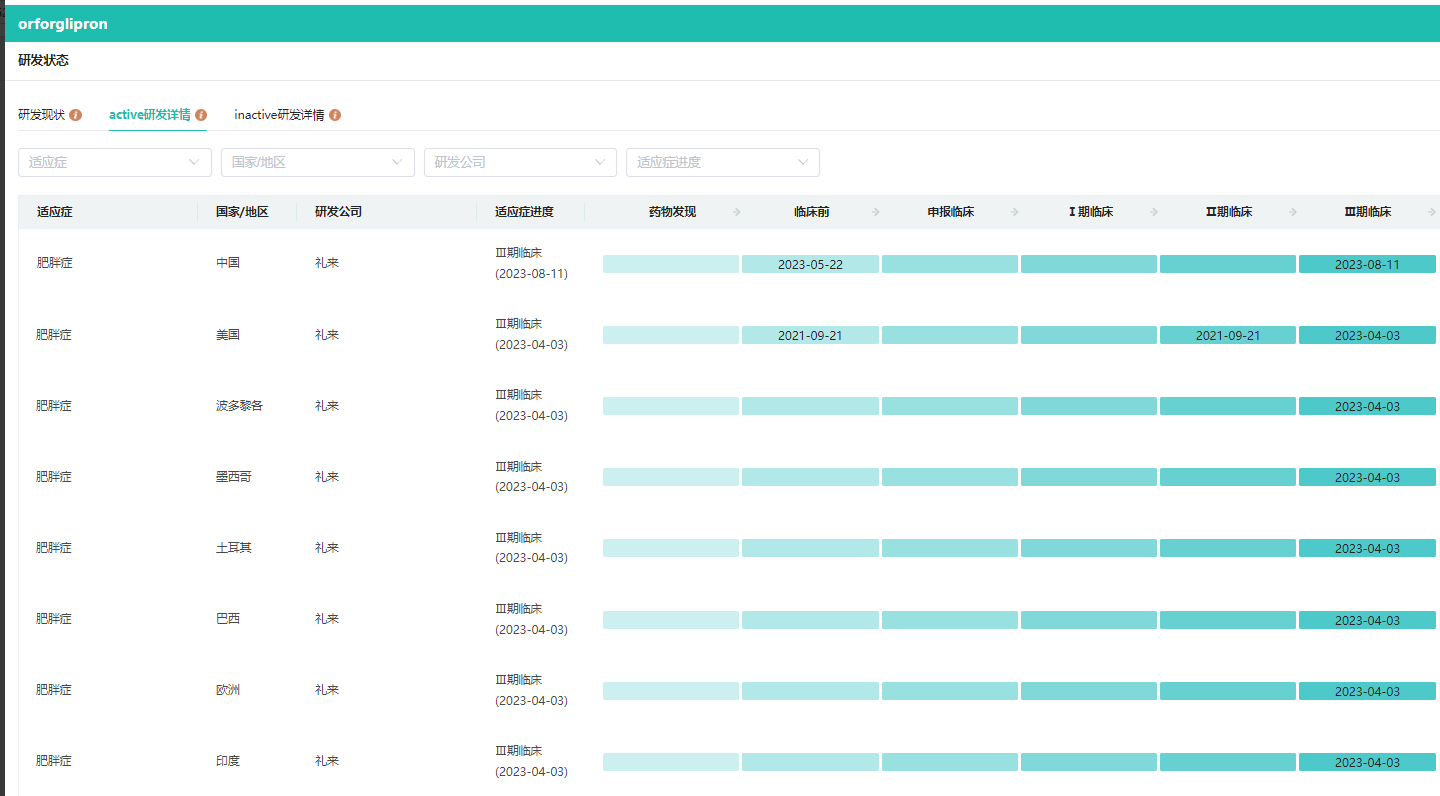
数据来源:药融云全球药物研发数据库
胰高血糖素样肽 1(GLP-1)是肠道细胞分泌的一种多肽类激素,它通过与 GLP-1 受体相结合,刺激胰岛素的分泌,并且抑制胰高血糖素的分泌,从而促进葡萄糖的新陈代谢。同时,它还能够能起到延缓胃排空和抑制食欲的后果。
因此,GLP-1 已经成为治疗肥胖症和 2 型糖尿病的有力靶点。
orforglipron 是礼来首款口服非肽 GLP-1 受体激动剂。该产品由 Chugai Pharmaceutical 公司发现,于 2018 年授权给礼来公司。该药的一个显著优势在于,它是一种非肽分子,这使其更容易被制造和包装成药片。与同类作用机制的疗法相比,这一特性还可能有助于提高产品在患者中的可负担性和可及性。
Retatrutide是礼来的第二款GCGR/GIPR/GLP-1R三重激动剂,它具有迄今为止最强的减肥效果。
国内市场,今年由华东医药申报的利拉鲁肽注射液(商品名:利鲁平)肥胖或超重适应症的上市许可申请获得批准。成为国内首家在GLP-1抑制剂领域获批减重适应症的企业。

数据来源:NMPA官网
目前,还有通化东宝、正大天晴、四环医药控股集团、广东东阳光药业有限公司等多方药企争相布局利拉鲁肽研发。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论