
8月10日,NMPA发布最新一批药品批准证明文件,其中,丽珠集团的布南色林片获批上市,成为国产第2家获批生产该品种的药企。

截图来源:NMPA官网
南色林原研来自日本住友制药,是一种新型的非典型抗精神病药,主要用于治疗精神分裂症,具有阻断多巴胺D2受体和5-HT2A受体的作用。与目前市场上的其他抗精神疾病药物相比,布南色林锥体外系的副作用反应更少。2017年,布南色林在中国获批上市,2020年通过谈判纳入全国医保乙类目录,随后该药品开始大幅增长,2022年院内销售额近5千万元,同比增长56%。
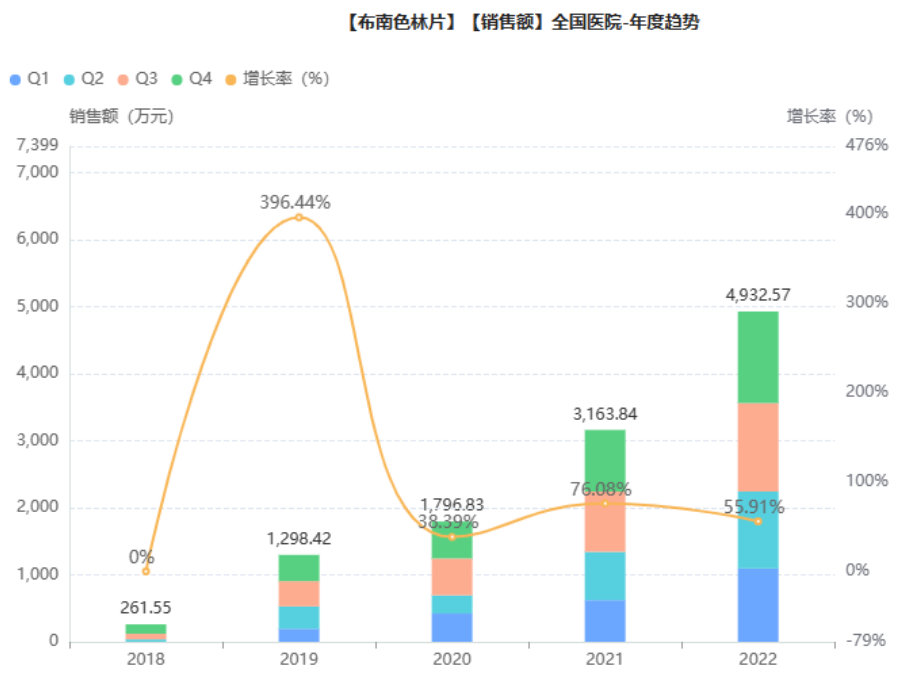
截图来源:药融云全国医院销售数据库
去年6月,石家庄四药的布南色林片率先获NMPA批准上市,斩获首仿+首家过评,此次丽珠集团为该品种第2家获批生产的本土药企。另有湖南省湘中制药、合肥英太制药、深圳市泛谷药业/厦门力卓药业递交了布南色林片的上市申请,在审评审批中。
仿制药方面,丽珠集团还有盐酸鲁拉西酮片、雷贝拉唑钠肠溶片、黄体酮注射液和硫酸镁钠钾口服用浓溶液等品种上市在审中,其中硫酸镁钠钾口服用浓溶液仅3家药企(1家原研,2家国产)获批,市场竞争较为温和,丽珠集团有望争夺国产第3家,尽早进入市场。
高壁垒复杂制剂方面,丽珠的注射用醋酸曲普瑞林微球 (1 个月缓释) 前列腺癌适应症已于 2023 年 5月获批上市,子宫内膜异位症III期临床试验已完成。注射用阿立哌唑微球 (1 个月缓释) 已进入临床后期,其他微球产品也在有序快速推进中。
生物药方面,丽珠集团有至少8个项目在研,其中托珠单抗注射液新适应症“用于CAR-T细胞起的CRS及SJIA”于2023年5月获批。重组抗人IL-17A/F人源化单克隆抗体注射液针对银屑病、中重度活动性强直性脊柱炎的两项适应症已正式启动III期临床试验(点击查看试验详情)。司美格鲁肽针对糖尿病适应症已进入临床lll期阶段(登记号:CTR20222962),预计2025年获批上市,后续将考虑申报减肥适应症。
此外,7月20日,丽珠医药宣布与上海华汇拓医药(华海药业子公司)签署《专利及技术转让协议》,以最高达8600万元的总交易额获得了凝血酶抑制剂HHT120在大中华区的所有权利、所有权和权益。这款1类新药可阻断血液凝固级联反应中纤维蛋白原的激活,从而阻断血栓的形成,将进一步丰富丽珠医药的产品管线。
<END>
要解锁更多企业药品研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药品各国上市情况、药品批文信息、销售情况与各维度分析、市场竞争格局、一致性评价情况、集采中标情况、药企申报审批信息、最新动态与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论