近日,FDA拒绝了Veru公司sabizabulin药物的紧急使用授权(EUA)申请,该药物用于治疗患有中度至重度Covid-19的住院成人患者,这些患者患有ARDS(急性呼吸窘迫综合征)的风险很高。

截图来源:药融云全球药物研发数据库
为了获得EUA,Veru提交了204名Covid-19住院患者的数据。因为临床效益,目前它提前停止了试验。
Veru首席执行官Mitchell Steiner表示,FDA拒绝使用该药是因为可能存在未知影响,或研究的不确定性。
在咨询委员会之前准备的简报文件中,FDA对Veru提交的关键数据表达了担忧。FDA表示,在小型试验中,虽然sabizabulin达到了降低死亡率的目标,但指出了不确定性或不平衡性,即使这些不确定性或不平衡性在个体上没有问题,但对结果提出了疑问。
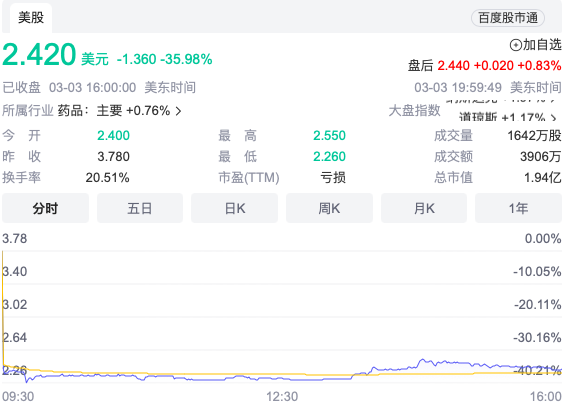
受此影响,Veru股价在盘前交易中下跌超35%,至2.42美元,目前总市值近2亿美元。
FDA的顾问委员会(AdComm)成员主要认为,试验没有足够的安全性和疗效数据,对药物的了解仍然有限。投票结果为8票对5票,许多人要求重新审判。
Veru表示,它仍然致力于为高风险患者群体开发sabizabulin,该药物正在其他国家接受监管审查。
Covid-19的治疗选择仍然有限,从抗体到抗病毒药物,许多新疗法都适用于轻中度患者。对于住院患者,FDA已经批准了几种抗炎药物,包括Actemra、Olumiant和Kineret。
2022年12月22日,FDA批准Actemra静脉注射用于治疗住院的成人COVID-19患者,是FDA批准的首个用于治疗新冠的单克隆抗体。
参考资料:
[1] www.endpts.com
[2] 药融云数据库
<END>








































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论