
2月13日,驯鹿生物(“IASO Bio”)宣布,美国食药监局(FDA)授予公司CAR-T细胞疗法CT103A再生医学先进疗法(RMAT)资格和快速通道(FT)资格,用于治疗复发/难治多发性骨髓瘤(RRMM)。

一、关于CT103A
据药融云数据库显示,CT103A是一种针对B细胞成熟抗原(BCMA)的CAR-T细胞疗法,以慢病毒为基因载体转染自体T细胞,CAR包含全人源scFv、CD8a铰链和跨膜、4-1BB共刺激和CD3ζ激活结构域。基于严格的筛选,通过全面的体内外功能评价,CT103A具有强有力和快速的疗效,并有突出的体内持久存续性。驯鹿生物和信达生物正在合作研发CT103A针对RRMM在中国的临床应用。
来源:药融云数据库
2022年12月22日,CT103A临床试验申请IND获FDA批准,在美国开展针对复发/难治性多发性骨髓瘤(R/R MM)的临床试验。
2022年6月,CT103A获NMPA正式受理用于治疗复发/难治性多发性骨髓瘤的NDA申请并纳入优先审评。
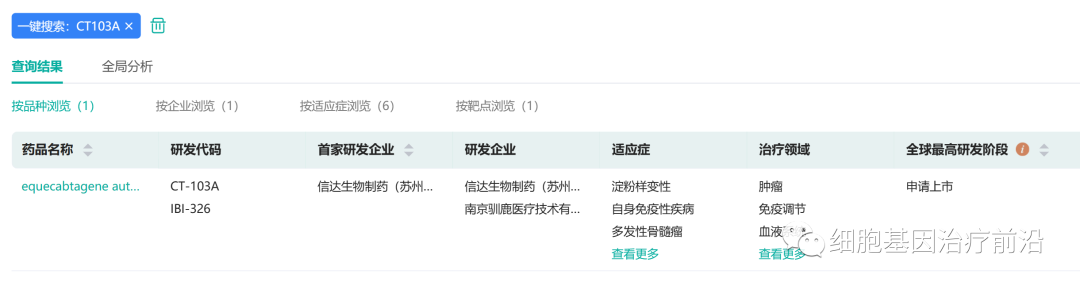
CT103A关于多发性骨髓瘤的研发现状
截图来源:药融云全球药物研发数据库
2022年2月,CT103A获FDA授予“孤儿药(ODD)”认定,用于治疗多发性骨髓瘤。
2021年2月,该CAR-T细胞疗法再获NMPA授予“突破性治疗药物”(BTD)认定,用于治疗复发/难治性多发性骨髓瘤。
截图来源:药融云全球药物研发数据库
2022年8月,CT103A新增拓展适应症AQP4-IgG 阳性的视神经脊髓炎谱系疾病(NMOSD)IND获NMPA批准。
二、关于驯鹿生物
驯鹿生物是一家处于临床阶段、致力于细胞创新药物开发的生物制药公司。公司拥有完整的从早期发现、注册申报、临床开发到商业化生产的全流程平台能力及包括了全人源抗体发现平台、高通量CAR-T细胞疗法药物优选平台、通用CAR技术平台、生产技术平台、临床转化研究平台在内的多个技术平台。
公司产品管线

截图来源:驯鹿生物官网
1月18日,驯鹿生物宣布完成近5亿元人民币C1轮融资。由国鑫投资、倚锋资本、上海外高桥集团和南京江北国资等11家投资机构共同参与。本轮募得资金主要用于公司产品管线的研发和临床推进以及核心产品伊基仑赛注射液的商业化运营。
驯鹿生物融资信息
截图来源:药融云投融资数据库
参考资料:
[1] 驯鹿生物官网:iasobio.com
[2] 药融云数据库
想要解锁更多药物研发信息吗?查询药融云数据库(vip.pharnexcloud.com/?zmt-mhwz)掌握药物基本信息、市场竞争格局、销售情况与各维度分析、药企研发进展、申报审批情况、最新市场动态、市场规模与前景等,以及帮助企业抉择可否投入时提供数据参考!注册立享15天免费试用!

<END>




























![医药高地:核药!恒瑞医药镥[177Lu]氧奥曲肽注射液获批临床](https://yaorongyun-public.oss-cn-shanghai.aliyuncs.com/images/covers/202302/09/e3938ad9f1d23e2fd043611c4a98c02a.png)










 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论