

(图源:NMPA官网)
国家药品监督管理局通过优先审评审批程序附条件批准江苏恒瑞医药股份有限公司申报的1类创新药瑞维鲁胺片(商品名:艾瑞恩)上市。该药适用于治疗高瘤负荷的转移性激素敏感性前列腺癌(mHSPC)患者。
据药融云数据库显示,瑞维鲁胺是一种雄激素受体(AR)抑制剂,可竞争性抑制雄激素与AR结合,从而抑制AR核移位及DNA结合,降低AR介导的基因转录。该品种上市为前列腺癌患者提供了新的治疗选择。
瑞维鲁胺基本信息
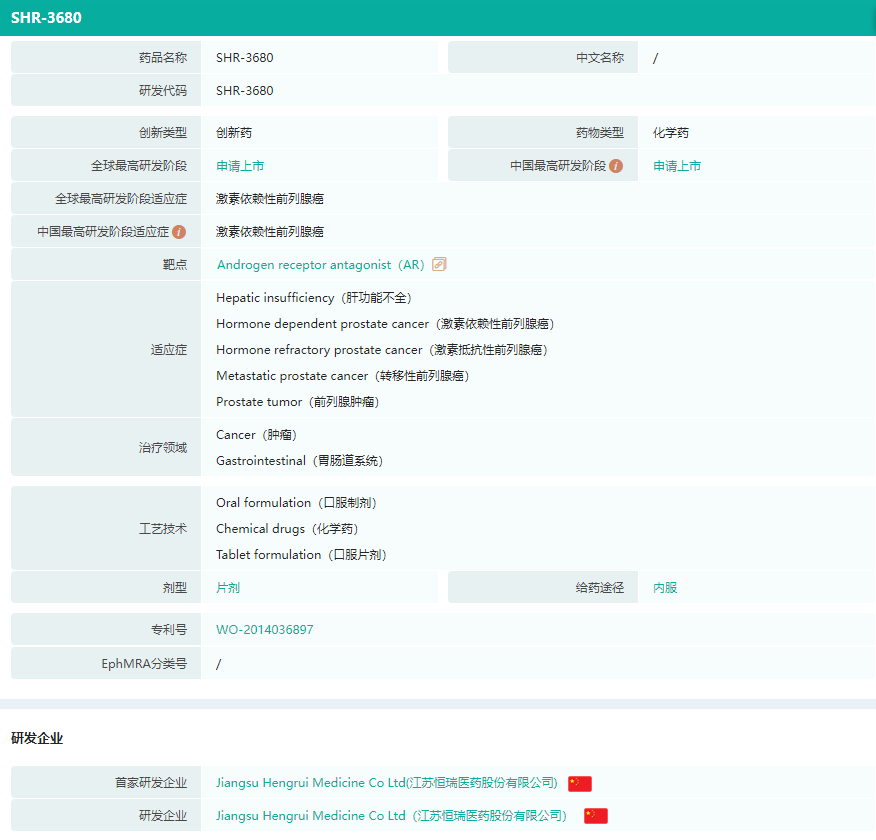
截图来源:药融云全球药物研发数据库(新版)
瑞维鲁胺除了此次的适应症已获批上市外,其余还有转移性前列腺癌、激素抵抗性前列腺癌进展较快。另外,瑞维鲁胺此前已先后获得国家突破性疗法和优先审评两项特殊审批认证。
瑞维鲁胺适应症研发状态

瑞维鲁胺特殊审批

截图来源:药融云全球药物研发数据库
医药一哥:十年十款新药
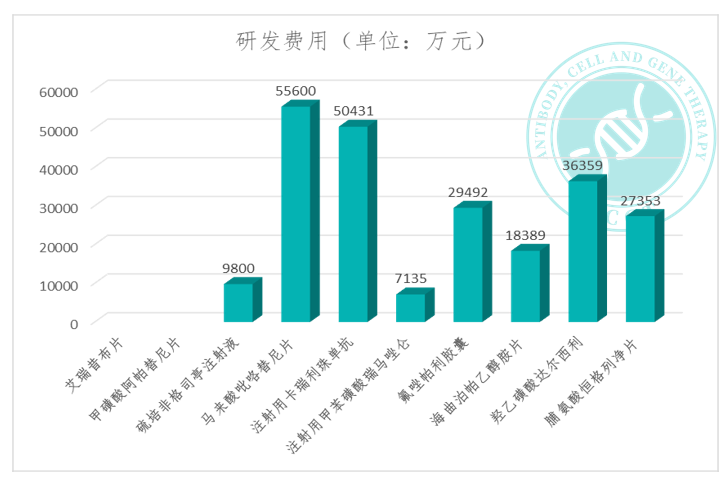
从2011年至2021年的10年时间里,恒瑞医药一共获得了国家药品监督管理局10款新药的上市批准。其中8款可查询到首次获批前研发费用投入,分别为:脯氨酸恒格列净片、羟乙磺酸达尔西利片、海曲泊帕乙醇胺片 、氟唑帕利胶囊、注射用甲苯磺酸瑞马唑仑、注射用卡瑞利珠单抗、马来酸吡咯替尼片、硫培非格司亭注射液(治疗用生物制品9类)。
每款平均研发费用大约在3亿元人民币左右,其中最高的是马来酸吡咯替尼片,前期研发投入约为55,600万元,最低的是注射用甲苯磺酸瑞马唑仑,这款咪达唑仑的改进化合物研发费用投入为7,135万元。但实际上,考虑到周期内未能上市的产品,整体的研发成本肯定会高于目前得到的数值。
下文是详细信息:
恒瑞医药10年(2011年至2021年)上市药物研发费用一览
(图源:靶点社整理)
1.脯氨酸恒格列净片
药品名称:脯氨酸恒格列净片
剂型:片剂
注册分类:化学药品 1 类
首次获批适应症:本品适用于改善成人2型糖尿病患者的血糖控制。
2021年12月获批,脯氨酸恒格列净是恒瑞医药的一种钠-葡萄糖协同转运蛋白 2(SGLT2)抑制剂,通过抑 制 SGLT2,减少肾小管滤过的葡萄糖的重吸收,从而增加尿糖排泄。截至获批时可查询的数据,脯氨酸恒格列净相关项目累计已投入研发费用约为 27,353 万元。
2.羟乙磺酸达尔西利片
药品名称:羟乙磺酸达尔西利片
剂型:片剂
注册分类:化学药品 1 类
首次获批适应症:本品联合氟维司群用于激素受体(HR)阳性,人表皮生长因 子受体 2(HER2)阴性的经内分泌治疗后进展的复发或转移性乳腺癌的治疗。
2021年12月获批,羟乙磺酸达尔西利是恒瑞医药自主研发的化学药品 1 类新药,是一种口服、 高效、选择性的小分子 CDK4/6 抑制剂。截至获批时可查询的数据,羟乙磺酸达尔西利相关项目累计已投入研发费用约 36,359 万元。
3.海曲泊帕乙醇胺片
药物名称:海曲泊帕乙醇胺片
剂型:片剂
注册分类:化学药品 1 类
首次获批适应症:用于因血小板减少和临床条件导致出血风险增加的既往对糖皮质激素、免疫球蛋白等治疗反应不佳的慢性原发免疫性血小板减少症(ITP)成人患者,以及对免疫抑制治疗疗效不佳的重型再生障碍性贫血(SAA)成人患者。其中SAA适应症为附条件批准。
2021年6月获批,海曲泊帕乙醇胺片是一种口服非肽类血小板生成素受体(TPO-R)激动剂,通过激活 TPO-R 介导的 STAT 和 MAPK 信号转导通路,促进血小板生成。截至获批时可查询的数据,恒瑞医药在海曲泊帕乙醇胺片相关项目累计已投入研发费用约为 18,389 万元。
4.氟唑帕利胶囊
药物名称:氟唑帕利胶囊
剂型:胶囊剂
注册分类:化学药品 1 类
首次获批适应症:用于既往经过二线及以上化疗的伴有胚系 BRCA 突变(gBRCAm)的铂敏感复发性卵巢癌、输卵管癌或原发性腹膜癌患者的治疗。
2020年12月获批,氟唑帕利为小分子PARP抑制剂,可抑制BRCA1/2功能异常细胞中的DNA修复过程,诱导细胞周期阻滞,进而抑制肿瘤细胞增殖。截至获批时可查询的数据,恒瑞医药该产品累计已投入研发费用约为 29,492 万元。
5.注射用甲苯磺酸瑞马唑仑
药品名称:注射用甲苯磺酸瑞马唑仑
剂型:注射剂
注册分类:化学药品 1 类
首次获批适应症:用于常规胃镜检查的镇静。
2019年12月获批,注射用甲苯磺酸瑞马唑仑是一种短效的 GABAa 受体激动剂,截至获批时可查询的数据,该研发项目上已投入研发费用约 7,135 万元人民币。
6.注射用卡瑞利珠单抗
药品名称:注射用卡瑞利珠单抗
剂型:注射剂
注册分类:治疗用生物制品 1 类
首次获批适应症:有条件批准用于治疗至少经过二线系统化疗的复发或难治性经典型霍奇金淋巴瘤。
2019年5月获批,注射用卡瑞利珠单抗是人源化抗 PD-1 单克隆抗体,可与人PD-1受体结合并阻断 PD-1/PD-L1 通路,恢复机体的抗肿瘤免疫力,从而形成癌症免疫治疗基础。恒瑞医药该产品项目投入研发费用约为 50,431 万元人民币。
7.马来酸吡咯替尼片
药品名称:马来酸吡咯替尼片
剂型:片剂
注册分类:化学药品1类
首次获批适应症:联合卡培他滨,适用于治疗表皮生长因子受体2(HER2)阳性、既往未接受或接受过曲妥珠单抗的复发或转移性乳腺癌患者。使用本品前患者应接受过蒽环类或紫杉类化疗。本次批准为有条件批准。
2018年8月获批,马来酸吡咯替尼是不可逆性人表皮生长因子受体2(HER2)、表皮生长因子受体(EGFR)双靶点的酪氨酸激酶抑制剂,其作用机理为与细胞内HER2和EGFR激酶区的三磷酸腺苷(ATP)结合位点共价结合,阻止肿瘤细胞内HER2和EGFR的同质和异质二聚体形成,抑制其自身的磷酸化,阻断下游信号通路的激活,从而抑制肿瘤细胞生长。恒瑞医药在该产品的研发项目已投入研发费用约为 55,600 万元人民币。
8.硫培非格司亭注射液
药品名称:硫培非格司亭注射液
剂型:注射剂
注册分类:治疗用生物制品 9 类
首次获批适应症:适用于非骨髓性癌症患者在接受易引起临床上显著的发热性中性粒细胞减少症发生的骨髓抑制性抗癌药物治疗时,降低以发热性中性粒细胞减少症为表现的感染的发生率。
2018年5月获批,硫培非格司亭是恒瑞医药自主研发的生物创新药长效粒细胞集落刺激因子(G-CSF)。截至获批时可查询的数据,硫培非格司亭注射液研发项目上已投入研发费用约为 9800 万元人民币。
9.甲磺酸阿帕替尼片
药品名称:甲磺酸阿帕替尼片
剂型:片剂
注册分类:化学药品1.1类
2014年12月获批,阿帕替尼主要用于晚期胃癌标准化疗失败后的治疗,通过竞争性结合细胞内VEGFR-2的ATP结合位点,抑制酪氨酸激酶的生成从而抑制肿瘤组织新血管的生成。阿帕替尼从立项研发到获批上市前后历时10 年,见证了恒瑞医药自主创新转型的历程。
10.艾瑞昔布片
药品名称:艾瑞昔布片
剂型:片剂
注册分类:化学药品1.1类
2011年6月获批,艾瑞昔布是新一代非甾体抗炎类创新药,主要用于缓解骨关节炎的疼痛症状,这是恒瑞医药第一个获批上市的国家一类新药。
参考来源:
[1] NMPA官网
[2] 恒瑞医药公开披露
[3] 药融云数据库
想要解锁更多药企创新药信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企创新药产品布局、基本信息、研发阶段、最新进展、申报获批情况、临床试验信息、市场规模与前景,可否投入研发!注册立享15天免费试用和虎年首份医药数据大礼包!

<END>







































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论