
据药融云数据库显示,5月9日,石药欧意公示了其哌柏西利片的生物等效性试验,规格为125mg,适用于激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性的晚期或转移性乳腺癌,应与芳香化酶抑制剂联合使用作为绝经后女性或男性患者的初始内分泌治疗或与氟维司群联合使用用于内分泌治疗后疾病进展的患者。
目前,国内仅齐鲁制药和原研辉瑞递交了哌柏西利片的上市申请。此外,哌柏西利的胶囊剂国内首仿也由齐鲁制药拿下。
石药欧意哌柏西利片相关信息

截图来源:药融云中国临床试验数据库
CDK4/6抑制剂已成为乳腺癌治疗的一类重要靶向药物,其中的先行者和佼佼者便是辉瑞的Palbociclib(Ibrance,哌柏西利)。
作为全球首个上市的 CDK4/6 抑制剂,2015年2月,辉瑞哌柏西利通过加快审评在美国获FDA 批准上市,成为全球上市的首个CDK4/6抑制剂;2018年7月获NMAP批准在国内上市。凭借其先发优势,上市后其全球销售额每年均呈稳定增长,为辉瑞带来相当丰厚的收益,202年哌柏西利销售额突破50亿美元大关,2021年达54.4亿美元。
辉瑞哌柏西利全球销售额

截图来源:药融云全球药物研发数据库
目前国内获批的哌柏西利仅胶囊剂型,齐鲁制药、正大天晴、科伦药业、重庆药友制药、豪森药业等多家本土药企也陆续递交了上市申请,其中哌柏西利仅胶囊国内首仿由齐鲁制药拿下,2020年12月获得3个品规的批文。由于辉瑞的原研专利在2023年1月10日才到期,目前国内哌柏西利胶囊仍是辉瑞一家独大。
不过,和哌柏西利在全球的炙手可热不同,哌柏西利胶囊在国内的市场还有待开拓。据药融云统计,2021年哌柏西利胶囊院内销售额近9千万元。值得一提的是,2019-2021年,辉瑞的哌柏西利均“提名”医保目录,但最终均未顺利进入医保。
哌柏西利胶囊院内销售情况
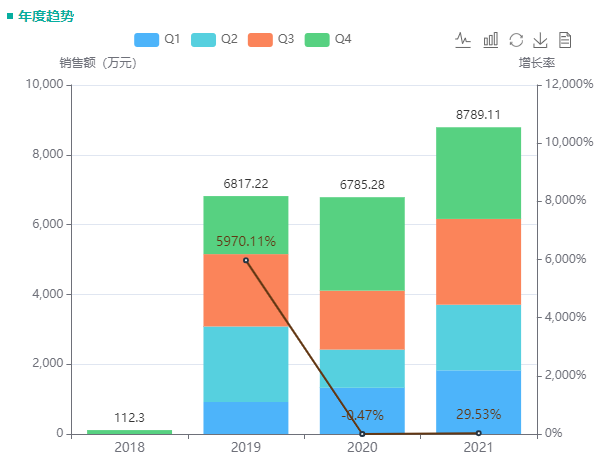
截图来源:药融云全国医院销售数据库
哌柏西利片是辉瑞开发的另一口服剂型,于2019年11月获FDA批准,有75mg、100mg、125mg三个规格。该品种于2020年12月向CDE递交上市申请,目前尚未获批。
齐鲁制药自拿下哌柏西利胶囊的首仿后,也递交了哌柏西利片的上市申请,并于2022年4月获CDE受理。而此次石药欧意公示BE试验,或有望于年内递交上市申请,与齐鲁制药共同争夺哌柏西利片的国内首仿。
哌柏西利片国内受理号
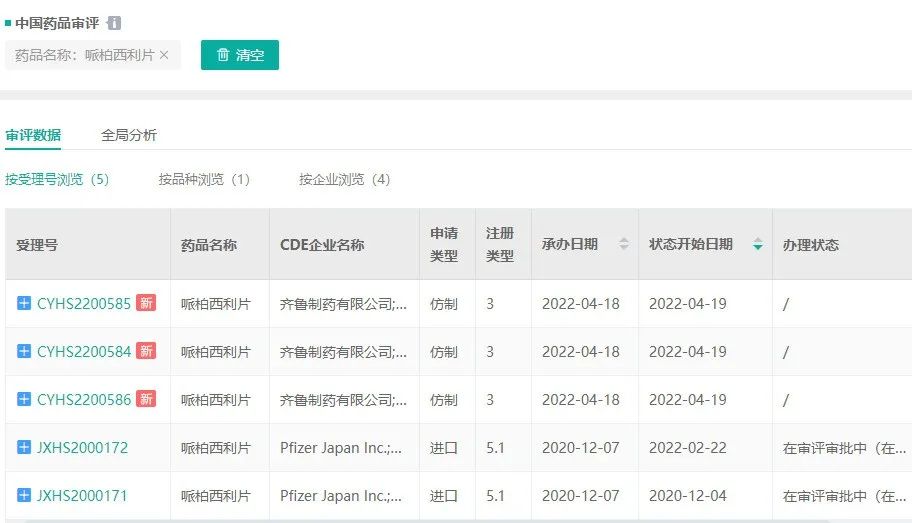
截图来源:药融云中国药品审评数据库
尽管目前国内尚未有企业对哌柏西利相关专利权无效挑战成功,但距离原研辉瑞专利过期也不算太久。后续仿制药的上市势必对其市场造成冲击,可以预见到时该产品市场竞争一片腥风血雨。不过这也将惠及更多患者,为患者提供更多的选择。
想要解锁更多药企仿制药信息吗?查询药融云数据库(https://www.pharnexcloud.com/?zmt-mhwz)掌握药企仿制药申报情况、审批信息、最新进展、一致性评价、市场竞争格局、销售情况,市场规模与前景,可否投入!注册立享15天免费试用和虎年首份医药数据大礼包!

—END—

















































 浙公网安备33011002015279
浙公网安备33011002015279 本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
本网站未发布麻醉药品、精神药品、医疗用毒性药品、放射性药品、戒毒药品和医疗机构制剂的产品信息
收藏
登录后参与评论
暂无评论